时间:2020-08-13 04:36:56
1、选择题 下列实验装置图合理的是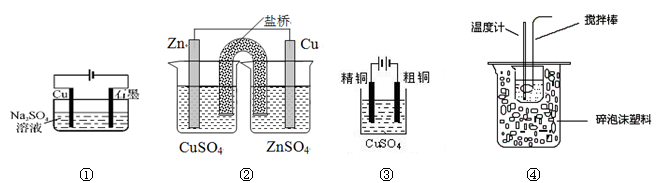
A.装置①所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑
Cu(OH)2+H2↑
B.装置②能构成锌铜原电池
C.装置③可用于粗铜的电解精炼
D.装置④可用于在实验室测定中和反应的反应热
2、选择题 已知:(1)C(s)+O2(g)=CO2(g) △H1
(2)CO2(g)+C(s)=2CO(g) △H2
(3)2CO(g)+O2(g)=2CO2(g) △H3
(4)4Fe(s)+3O2(g)=2Fe2O3(s) △H4
(5)3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1=△H2+△H3
B.△H2>0,△H4>0
C.△H1>0,△H3<0
D.△H3=△H4+△H5
3、选择题 下列物质中,只有共价键的是( )
A.NaCl
B.KOH
C.H2O
D.NH4Cl
4、选择题 在250C、101kPa,1g甲醇燃烧生成二氧化碳和液态水放热22.7 kJ, 甲醇燃烧热的热化学方程式书写正确的是
A.CH3OH(l) + 3/2O2(g)= CO2(g) + 2H2O(l) △H= -726.4 kJ/mol
B.2CH3OH(l) + 3O2(g)= 2CO2(g) + 4H2O(l) △H=" -1452.8" kJ/mol
C.2CH3OH(l) + 3O2(g)= 2CO2(g) + 4H2O(l) △H= -726.4 kJ/mol
D.2CH3OH(l) + 3O2(g)= 2CO2(g) + 4H2O(l) △H= +1452.8 kJ/mol
5、选择题 已知反应:① 2C(s)+O2(g)=2CO(g)? ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l)? ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量