时间:2020-08-13 04:34:12
1、计算题 BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和??洗涤沉淀;检验沉淀中氯离子是否洗净的方法是??。
(2)计算BaCl2·xH2O中的x=??(要求写出计算过程)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果??(填“偏低”、“偏高”或“不变”)。
参考答案:
(1)蒸馏水取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净。
(2)2。
(3)偏高。
本题解析:
(1)洗涤沉淀,需要用蒸馏水冲洗;若沉淀洗涤后洗涤液中不含Cl—则已经洗净,然后检验滤液中是否含有Cl—即可。
(2)计算氯化钡和水的物质的量比,即求出x;
样品中BaCl2的物质的量为n(BaCl2)= 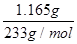 =5.000×10-3mol
=5.000×10-3mol
质量m(BaCl2)=5.000×10-3mol×208g/mol=1.040g
n(H2O):n(BaCl2)= 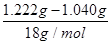 :(5.000×10-3mol)=2.02≈2
:(5.000×10-3mol)=2.02≈2
(3)题中已经表明硫酸钡被还原为BaS,则沉淀质量减小,相对水的质量比提高,x数据将偏高。
【考点定位】本题考查BaCl2·xH2O中结晶水数目的测定。
本题难度:一般
2、选择题 有关物质的检验,以下说法正确的是( )
A.向某溶液中滴加AgNO3溶液,生成白色沉淀,说明原溶液中含有Cl-
B.某气体可以使燃着的木条熄灭,说明该气体是CO2
C.加入盐酸,放出能使澄清石灰水变浑浊的无色无味的气体,不一定是含有CO32-
D.向某溶液中滴加BaCl2溶液,有白色沉淀产生,说明原溶液中一定存在CO32-或者SO42-
参考答案:A、向某溶液中滴加AgNO3溶液,生成白色沉淀,说明原溶液中含有Cl-或是CO32-等离子,故A错误;
B、某气体可以使燃着的木条熄灭,说明该气体是CO或是CO2中的至少一种,故B错误;
C、加入盐酸,放出能使澄清石灰水变浑浊的无色无味的气体,则溶液中可以含有碳酸根离子、碳酸氢根离子、亚硫酸根离子或是亚硫酸氢根离子中的至少一种,故C正确;
D、向某溶液中滴加BaCl2溶液,有白色沉淀产生,说明原溶液中存在CO32-、SO42-、Ag+中的至少一种,故D错误.
故选C.
本题解析:
本题难度:一般
3、选择题 下列各组中两瓶无标签的无色溶液,不用其他试剂能鉴别出来的一组是( )
A.AlCl3和NaOH
B.NaHCO3和NaOH
C.Na2SO4和BaCl2
D.AgNO3和NaCl
参考答案:A.氯化铝溶液和氢氧化钠溶液,试剂添加顺序不同产生的现象不同,氯化铝中滴加NaOH先生成沉淀后沉淀消失,而NaOH中滴定氯化铝先没有沉淀后生成沉淀,则不用其他试剂能鉴别,故A选;
B.二者改变添加顺序,产生现象相同,均反应生成碳酸钠和水,不用其他试剂不能鉴别,故B不选;
D.二者改变滴加顺序,产生现象相同,均生成硫酸钡沉淀,不用其他试剂不能鉴别,故C不选;
D.二者改变滴加顺序,产生现象相同,均生成AgCl白色沉淀,不用其他试剂不能鉴别,故D不选;
故选A.
本题解析:
本题难度:一般
4、实验题 为验证木炭可被浓硫酸氧化成二氧化碳,选用下图仪器(含所盛物质),组装成套实验装置,试回答下列问题。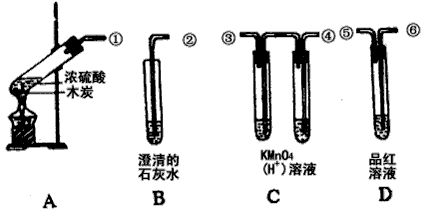
(1)在实验进行中,按气流方向从左到右顺序,导管口的连接应该是______ 接_______,_______接_____ ,______ 接_______ 。
(2)试管B、D中各有什么现象,才能表示已检出二氧化碳? B中 __________,D中__________ 。
(3)写出A装置中反应化学方程式:__________ 。 B装置中反应的离子方程式:____________ 。
参考答案:(1)①④③⑥⑤②
(2)“略”
(3)“略”
本题解析:
本题难度:一般
5、填空题 (14分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
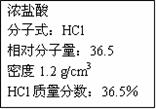  |
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
| ? | ? |
 处,改用?加水,使溶液凹面恰好与刻度相切。
处,改用?加水,使溶液凹面恰好与刻度相切。 匀。
匀。 子转移的方向和数目:
子转移的方向和数目:参考答案:(1)? 12mol/L? (2分)?
(2)2.1 ?(2分) ?250 (1分)?烧杯(1分)?胶头滴管 (1分)
(3)①无影响? (1分)?②偏小 (1分)?③偏大 (1分)
(4) ①(2分)
得到10e-
2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
失去10e-
②? 0.05 mol(1分)? 3.16g(1分)
本题解析:略
本题难度:一般