时间:2020-08-13 04:32:48
1、选择题 下列说法正确的是:
A.离子化合物一定含有离子键
B.共价化合物一定不含离子键
C.只含共价键的物质叫共价化合物
D.化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程
2、填空题 (1)氯元素的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: 。
(2)已知:Fe2O3(s) + 3/2C(s) = 3/2CO2(g) + 2 Fe(s) ΔH =234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔH = —393.5 kJ·mol-1
则2 Fe(s)+ 3/2O2(g) = Fe2O3(s) 的ΔH是 kJ·mol-1。
(3)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示。已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。根据以上信息和数据,写出N4气体转变为N2的热化学方程式: 。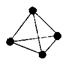
(4)下图是丙烷(C3H8)、二甲醚(CH3OCH3)燃烧过程中能量变化图,其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式: 。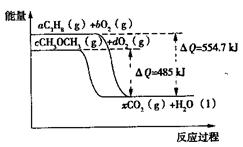
3、填空题 (9分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式______________________________________.
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式___________________.
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l ) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______________________.
4、选择题 化学与能源开发、环境保护、生产生活等密切相关。下列叙述错误的是
A.光催化水制氢比电解水制氢更节能环保
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.开发利用可再生能源,可减少化石燃料的使用
D.改进汽车尾气净化技术,可减少大气污染物的排放
5、简答题 有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤H2O、⑥Na2O2.
(1)上述物质中,属于共价化合物的是______(填序号,下同),既存在离子键又存在非极性键的是______
(2)②号物质的电子式为______、用电子式表示⑤号物质的形成过程:______.