时间:2020-08-13 04:31:26
1、选择题 已知热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b,下列说法正确的是[ ]
A.该反应的ΔH2=+483.6kJ/mol
B.|ΔH2|<|ΔH1|
C.|ΔH2|>|ΔH1|
D.热化学方程式中化学计量数表示分子个数
参考答案:C
本题解析:A 错误,该反应的ΔH2>+483.6kJ/mol ,如果是气态水分解,ΔH2="+483.6kJ/mol" 但该反应是液态水分解,所以吸收的热量要大于483.6kJ,由此可知,B 选项错误,C选项正确,
D 错误,热化学方程式中化学计量数不仅表示分子个数,也表示物质的量。
本题难度:一般
2、填空题 Ⅰ.氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol 请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量。写出该反应的热化学方程式 。
参考答案:Ⅰ.(1)小于 (2)< Ⅱ.Cu(s)+1/2O2(g)=CuO(g) △H=-157kJ/mol
本题解析:Ⅰ.(1)氢气燃烧是放热反应,所以生成物的总能量小于反应物的总能量。
(2)应用气态水的能量高于液态水的能量,因此氢气燃烧生成液态水时放出的能量多,则2 mol氢气完全燃烧生成水蒸气,则放出的热量<572 kJ。
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量,则该反应的热化学方程式Cu(s)+1/2O2(g)=CuO(g) △H=-157kJ/mol。
考点:考查反应热的计算以及热化学方程式的书写
点评:该题是基础性试题的考查,难度不大。明确反应热与反应物和生成物总能量的相对大小是答题的关键。有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:一般
3、选择题 在指定溶液中,下列各组离子一定能大量共存的是
A.pH=1的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=13的溶液:Na+、K+、AlO2-、CO32-
参考答案:D
本题解析:分析:A.pH=1的溶液呈酸性,在酸性条件下反应的离子不能大量共存;
B.由水电离出的c(H+)=1×10-13mol/L的溶液可能呈酸性,也可能呈碱性;
C.含大量Fe3+的溶液,与Fe3+反应的离子不能大量共存;
D.pH=13的溶液呈碱性,如离子之间不发生任何反应,则可大量共存.
解答:A.pH=1的溶液呈酸性,酸性条件下Fe2+与NO3-发生氧化还原反应而不能大量共存,故A错误;
B.由水电离出的c(H+)=1×10-13mol/L的溶液可能呈酸性,也可能呈碱性,无论酸性还是碱性,HCO3-都不能大量共存,故B错误;
C.含大量Fe3+的溶液,与Fe3+反应的SCN-离子不能大量共存,故C错误;
D.pH=13的溶液呈碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存问题,综合考查学生化学知识的应用能力,为高考常见题型,注意把握常见离子的性质,把握提给信息,为解答该题的关键,注意A发生氧化还原反应的特点,为易错点,题目难度中等.
本题难度:困难
4、选择题 下列热化学方程式书写正确的是( )
A.2SO2+O2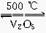 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+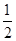 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ·mol-1
D.C(s)+O2(g)===CO2(g)ΔH=393.5 kJ·mol-1
参考答案:B
本题解析:考查热化学方程式的正误判断。热化学方程式是表示化学反应与反应热关系的方程式。书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数。
②各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液。
③反应热与反应方程式相互对应。若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同。
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略。所以只有选项B是正确的,其余都是错误的,答案选B。
本题难度:一般
5、填空题 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1
CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g) ΔH3
6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3= kJ·mol-1。
(2)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1="-197" kJ·mol-1;
2SO3(g) ΔH1="-197" kJ·mol-1;
H2O(g) H2O(l) ΔH2="-44" kJ·mol-1;
H2O(l) ΔH2="-44" kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) 2H2SO4(l) ΔH3="-545" kJ·mol-1。
2H2SO4(l) ΔH3="-545" kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是 。
(3)大气中的部分碘源于O3对海水中I-的氧化。O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g) IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为 ,其反应热ΔH= 。
参考答案:(1)2 821.6
(2)SO3(g)+H2O(l) H2SO4(l) ΔH="-130" kJ·mol-1
H2SO4(l) ΔH="-130" kJ·mol-1
(3)O3+2I-+2H+ I2+O2+H2O ΔH1+ΔH2+ΔH3
I2+O2+H2O ΔH1+ΔH2+ΔH3
本题解析:(1)ΔH3=ΔH1+6ΔH2="+2" 821.6 kJ·mol-1。(2)ΔH=(ΔH3-ΔH1-2ΔH2)/2="-130" kJ·mol-1。(3)将已知3个热化学方程式连加可得O3+2I-+2H+ I2+O2+H2O,由盖斯定律得ΔH=ΔH1+ΔH2+ΔH3。
I2+O2+H2O,由盖斯定律得ΔH=ΔH1+ΔH2+ΔH3。
考点:化学反应与能量、盖斯定律、热化学方程式的书写
本题难度:一般