时间:2020-08-13 04:27:59
1、选择题 下列关于硫酸的说法不正确的是
A.是化合物
B.是氧化物
C.是含氧化物
D.是含氧酸
参考答案:B
本题解析:分析:硫酸在水中电离出的阳离子只有氢离子属于酸;硫酸中含有氧元素,所以属于含氧酸;硫酸是由氢、氧、硫元素组成的纯净物,属于化合物.
解答:A、硫酸是由氢、氧、硫元素组成的纯净物,属于化合物,故A正确;
B、硫酸中含有氧元素,还含有H、S两种元素,氧化物中只含有两种元素,并且其中一种是氧元素的化合物,故B错误;
C、硫酸中含有氧元素,属于化合物,是含氧化合物,故C正确;
D、硫酸在水中电离出的阳离子只有氢离子属于酸,硫酸中含有氧元素,所以属于含氧酸,故D正确.
故选B.
点评:本题考查学生酸、汉阳算、含氧化合物、氧化物的概念知识,可以根据教材知识来回答,较简单.
本题难度:困难
2、选择题 X、Y、Z、W原子系数依次增加的短周期元素。已知①X、Y的氢化物的熔沸点在所在族中是最高,且常温下X、Y的氢化物的状态不同。②Y与Z是同一族。下列说法正确的是(?)?
A.四种元素中,原子半径最大的是W
B.X元素的最高价氧化物对应的水化物酸性最强
C.单质的氧化性:W > Z
D.气态氢化物的熔点和沸点:Z> Y
参考答案:C
本题解析:X、Y的氢化物的熔沸点在所在族中是最高的,且常温下X、Y的氢化物的状态不同,在短周期中能形成氢键只有三种元素,N、F、O。常温下X、Y的氢化物的状态不同
得出Y为氧元素,则X为氮元素,Y与Z是同一族,则Z为硫元素,W为氯元素。A,四种元素中,原子半径最大的是硫;B,X、Z、W三种元素的最高价氧化物所对应的水化物中,酸性最强的是HClO4;C,因为氯和硫为同周期元素,氯的原子半径比硫原子小,氧化性比硫强;D,相同条件下,Z、Y形成的气态氢化物为H2S和H2O,它们结构相似,相对分子质量越大,其熔点和沸点越高。但是水分子之间有氢键,分子间作用力强,常温为液体,H2S为气体,水比H2S熔沸点高。
本题难度:一般
3、选择题 A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A、n+8? B、n+18? C、n+32? D、n+20
参考答案:D
本题解析:各周期元素种数:2 8 8 18 18 32 26;
若A、B在一、二周期,则B的原子序数:n+2或 n+8;
若A、B在二、三周期,则B的原子序数:n+8;
若A、B在三、四周期,则B的原子序数:n+8或 n+18;
若A、B在四、五周期,则B的原子序数:n+18;
若A、B在五、六周期,则B的原子序数:n+18或n+32?;
若A、B在六、七周期,则B的原子序数:n+32?;
本题难度:一般
4、选择题 在1s、2px、2py、2pz轨道中,具有球对称性的是(?)。
A.1s
B.2px
C.2py
D.2pz
参考答案:A
本题解析:1s轨道和2p轨道的图像分别为: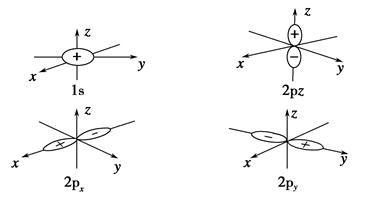
由图像可看出,呈球对称性的为1s原子轨道。
本题难度:一般
5、填空题 现有A、B、C、D、E、F六种短周期元素,A、E处于同一主族且E是短周期元素中原子半径最大的元素(不含稀有气体)。已知C的原子序数等于A、B的原子序数之和;D的原子序数等于A、C的原子序数之和。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。F是一种生活中常用的金属。根据以上信息,回答下列问题:
(1) 写出元素B在周期表中的位置_____________。
(2) 写出F的单质与E的最高价氧化物对应水化物反应的化学方程式______________。
(3) 比较C、D气态氢化物的稳定性______>_______(填化学式);比较D、E、F原子半径的大小______>________>_______(填元素符号)。
(4) 在A、B、D三种元素中选择两种或三种元素组成两种可以发生反应的阴离子,请写出该反应的离子方程式________________________________________。
参考答案:(1)第二周期第IVA族(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
(3) H2O>NH3? Na>Al>O? (4)OH—+HCO3—= H2O+ CO32—(2分)
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E、F六种短周期元素分别是H、C、N、O、Na、Al。
(1)碳元素的原子序数是6,位于第二周期第IVA族。
(2)单质铝能和氢氧化钠溶液反应生成氢气,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
(3)非金属性越强,氢化物的稳定性越强,所以稳定性是H2O>NH3;同周期在左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序是Na>Al>O。
(4)符合条件的阴离子是OH-和HCO3-,方程式为OH—+HCO3—= H2O+ CO32—。
本题难度:一般