时间:2020-07-28 05:58:39
1、简答题 10℃时加热NaHCO3饱和溶液,测得该溶液的PH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ PH 8.3 8.4 8.5 8.8 |
参考答案:NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,加热时,NaHCO3可分解生成Na2CO3,Na2CO3水解程度较大,溶液碱性较强,
故答案为:HCO3-+H2O?H2CO3+OH-;大于;
(1)加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,乙同学结论正确,而加入A、D都生成沉淀,不能正确,加入C无现象,故答案为:乙;B;
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,说明碳酸氢钠没有分解,则甲正确,故答案为:甲;
(3)如NaHCO3的分解温度为150℃,则乙的结论肯定错误,原因是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,
故答案为:乙;常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
本题解析:
本题难度:简单
2、选择题 H2A是二元弱酸,KHA溶液呈酸性。在0.1mol·L-1 KHA溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HA-)+c(OH-)+c(A2-)? B.c(HA-)+c(A2-)=0.1mol·L-1
C.c(A2-)>c(H2A)? D.c(K+)=c(H2A)+c(HA-)+c(A2-)
参考答案:CD
本题解析:在0.1mol·L-1 KHA溶液中,根据电荷守恒可以得到,c(K+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),故A错误,根据物料守恒,可以得到c(HA-)+c(A2-)+c(H2A)=0.1mol·L-1,故B错误,因为KHA溶液呈酸性,所以HA-的电离大于水解,故c(A2-)>c(H2A) ,所以C正确,根据物料守恒可以得到c(K+)=c(H2A)+c(HA-)+c(A2-) ,故D正确,所以本题的正确答案选择CD。
点评:本题考查水溶液中的电荷守恒、物料守恒,该知识点是高考考查的重点和难点,本题难度适中。
本题难度:一般
3、选择题 Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ +2H2O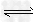 Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是?
Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是?
[? ]
A、因为增大了H+的浓度,导致平衡逆移,所以Fe2+的浓度增大 ?
B、平衡正向移动?
C、溶液颜色由浅绿色变黄色?
D、生成红褐色沉淀
参考答案:C
本题解析:
本题难度:一般
4、选择题 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
参考答案:D
本题解析:根据题意可知,二者恰好反应生成氨水和氯化钠,氯化钠是强电解质,氨水是弱碱,存在电离平衡,溶液显碱性,所以正确的答案选D。
点评:本题主要考查浓度相同的强弱电解质在溶液中离子浓度大小的比较。
本题难度:一般
5、选择题 有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB====A++HB-,HB- H++B2-
H++B2-
其中错误选项的组合是(? )
A.①②
B.③④
C.②③
D.①④
参考答案:B
本题解析:酸式盐AHB的水溶液呈弱碱性,说明AOH的碱性相对较强,H2B的酸性相对较弱,且HB-的电离程度小于HB-的水解程度,相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度。AHB溶液的电离方程式一般写成AHB====A++HB-,HB- H++B2-
H++B2-
本题难度:一般