时间:2020-07-28 05:58:39
1、选择题 下列物质在常温下发生水解时,对应的离子方程式正确的是()
A.Na2CO3: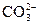 +2H2O
+2H2O H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4NO3: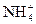 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
C.CuSO4:Cu2++H2O Cu(OH)2+2H+
Cu(OH)2+2H+
D.KF:F-+H2O====HF+OH-
参考答案:B
本题解析:A.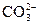 为弱酸根离子,分步水解,
为弱酸根离子,分步水解,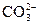 +H2O
+H2O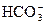 +OH-,
+OH-,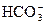 +?H2OH2CO3+OH-,阳离子水解可一步写,如C(但未配平)。
+?H2OH2CO3+OH-,阳离子水解可一步写,如C(但未配平)。
本题难度:简单
2、填空题 (1)①在配制FeCl3溶液时,常在溶液中加入一些_________________以抑制其水解;其水解反应的离子方程式为?
②用Al2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。?
③请按顺序排列出1mol/LNH4Cl溶液中各种离子浓度大小关系_________。请详细解释该溶液呈现酸性、碱性或中性的原因_______________________?。
(2)25℃时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得溶液的pH=10。试回答以下问题:
所得溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(3)将相同温度下相同浓度的下列溶液:
A.HCl
B.CH3COOH
C.NH4Cl
D.CH3COONa E.NaOH F.NaCl
按pH由大到小的顺序排列?(填序号)
(4)加热蒸干AlCl3溶液得到?;接下来灼烧得?;(填化学式)
用离子方程式及简短的文字说明原因?
参考答案:(1)①盐酸离子方程式为? Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
②离子方程式Al3++3HCO3=3Al(OH)3+3CO2
③离子浓度大小关系_c(Cl-)>c(NH4+).>c(H+)>COH-);NH4+与水电离出的OH-结合生成弱电解质NH3.H2O,破坏了水的电离平衡,导致c(H+)>COH-)
(2)①>(3)E>D>F>C>B>A
(4)? Al(OH)3?;? Al2O3?;(填化学式)
在AlCl3溶液中存在平衡AlCl3?+3H2O Al (OH)3+3HCl加热时, HCl不断挥发,使平衡右移,从而生成了Al (OH)3.灼烧时2Al(OH)3=Al2O3+3H2O
Al (OH)3+3HCl加热时, HCl不断挥发,使平衡右移,从而生成了Al (OH)3.灼烧时2Al(OH)3=Al2O3+3H2O
本题解析:略
本题难度:一般
3、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是?(?)
参考答案:C
本题解析:A、电荷守恒来看,RO32-要乘以2;
B、碳酸铵水解相互促进,硫酸铵正常水解,硫酸铁铵相互抑制,故铵根浓度③>②>①;
C、电荷守恒;
D、根据质子守恒列式,错误。HS-,本身就有。
本题难度:一般
4、选择题 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是(?)
A.c(OH-)>c(HA)>c(HB)>c(H+)? B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)? D.c(OH-)>c(HB)>c(HA)>c(H+)
参考答案:A
本题解析:HA酸性越弱,A-水解程度越强,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,C(Na+)>C(B-)>C(A-)> c(OH-)>c(HA)>c(HB)>c(H+),故A 正确。
本题难度:一般
5、选择题 在蒸发皿中加热蒸干再加热(低于400℃)下列物质的溶液,可以得到该物质固体的是(?)
A.氯化铝
B.碳酸氢钠
C.硫酸亚铁
D.硫酸镁
参考答案:D
本题解析:A.氯化铝是强酸弱碱盐。加热促进盐水解产生氢氧化铝和盐酸。盐酸有挥发性,会随着水分的蒸发而挥发,所以蒸干得到的固体为氢氧化铝。再加热氢氧化铝分解得到氧化铝。错误。B.碳酸氢钠溶液蒸干得到NaHCO3.再加热发生分解反应2NaHCO3 Na2CO3+CO2↑+H2O。因此最后得到的固体为Na2CO3。错误。C.硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸亚铁。但是由于在加热的过程中有空气中的氧气参加反应,因此硫酸亚铁会被氧化为硫酸铁。所以固体为硫酸铁。错误。D.硫酸镁硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸镁,最后的固体为硫酸镁。正确。
Na2CO3+CO2↑+H2O。因此最后得到的固体为Na2CO3。错误。C.硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸亚铁。但是由于在加热的过程中有空气中的氧气参加反应,因此硫酸亚铁会被氧化为硫酸铁。所以固体为硫酸铁。错误。D.硫酸镁硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸镁,最后的固体为硫酸镁。正确。
本题难度:一般