时间:2020-07-28 05:57:36
1、填空题 (2分)把1120 mL(标准状况时的体积)氯化氢溶解于水,配制成500 mL溶液,该溶液的氢离子浓度为 mol / L,溶液的pH值为 。
参考答案:0.1; 1
本题解析:略
本题难度:简单
2、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是(? )
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
C.12.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA
D.0.5mol雄黄(As4S4,结构如图)含有NA个S—S键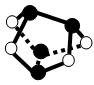
参考答案:B
本题解析:A. 5.6 g铁粉在0.1mol氯气中充分燃烧,铁粉有剩余,氯气反应完了,故转移电子数为0.2NA,A错误。
B. 7.8g Na2S和Na2O2的混合物为0.1mol,两种物质均只含一个阴离子,故阴离子数等于0.1NA,B正确。
C.硫酸变稀后,铜与其不再反应,故硫酸反应不完,转移电子数小于0.2NA,C错误。
D.通过观察可知,黑球表示As原子,白球表示S原子,故雄黄中不存在S—S键,D错误。
故选B
本题难度:简单
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.0.1mol·L-1的Na2CO3溶液中,阴离子的总数目大于0.1NA
B.常温下,46 g NO2和N2O4混合气体中含有的分子总数为2NA
C.标准状况下,22.4L的HF含有NA个分子
D.标准状况下,10g的庚烷分子中含有2.2NA个共价键
参考答案:D
本题解析:A.只有浓度缺少体积,无法计算微粒的物质的量,错误;B.常温下,46 g NO2的分子数是NA个,46 g N2O4气体中含有的分子总数为0.5NA,所以混合气体的分子数小于NA个,错误;C.标准状况下,HF分子之间存在氢键,一聚合分子形式存在,因此22.4L的HF含有分子多于NA个,错误;D.标准状况下,10g的庚烷C7H16分子中含有的共价键数是(10g ÷100g/mol)×22NA=2.2NA个共价键,正确。
考点:考查阿伏加德罗常数的计算的知识。
本题难度:一般
4、选择题 今有0.1 mol/L Na2SO4溶液300 mL,0.1 mol/L MgSO4溶液200 mL和0.1 mol/L Al2(SO4)3溶液100 mL,这三种溶液中SO42-的物质的量浓度之比是
A.1∶1∶1
B.3∶2∶2
C.3∶2∶3
D.1∶1∶3
参考答案:D
本题解析:三种溶液中SO42-的物质的量浓度之比是0.1 mol/L:0.1 mol/L:0.1 mol/L×3= 1∶1∶3,选D。
本题难度:一般
5、填空题 化合物A是一种不稳定的物质,它的分子组成可用OxFy来表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
(1)我们可以通过计算来确定A的化学式为 ,摩尔质量为 g/mol
(2)已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,
结构式是 。
参考答案:(1) O3F2 86 g/ mol (2) F—O—O—O—F
F—O—O—O—F
本题解析:
试题解析:(1)根据原子守恒配平方程式,
OxFy = x/2O2 + y/2F2,
1×22.4L x/2×22.4L y/2×22.4L
10mL 15mL 10mL
所以x=3;y=2;故答案为:O3F2(2)该分子中含3个O原子,根据“A分子中X个氧原子是…-O-O-O-…链状排列”知,两个F原子位于该分子的两端,所以该分子的结构式为F-O-O-O-F,电子式为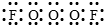 .故答案为:
.故答案为: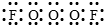 ,F-O-O-O-F。
,F-O-O-O-F。
考点:方程式的计算 电子式 结构式
本题难度:一般