时间:2020-07-28 05:56:35
1、选择题 已知反应:
①101 kPa时,2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H +(aq)+OH-(aq) ====H2O(l) ΔH=-57.3 kJ·mol-1
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)====P4O10(s) ΔH=-3 093.2 kJ·mol-1
4P(s)+5O2(g)====P4O10(s) ΔH=-2 954.0 kJ·mol-1
下列结论正确的是
A.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低
B.碳的燃烧热大于221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的反应热ΔH=-57.3 kJ·mol-1
D.浓硫酸与稀NaOH溶液反应生成1 mol水,放出热量大于57.3 kJ
参考答案:D
本题解析:由题给信息③知,等质量的白磷比红磷燃烧放出的热量多,则等质量的红磷能量比白磷低,红磷转化为白磷是吸热反应,A项错误;燃烧热是指,在25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,根据题给信息只能判断碳的燃烧热不是221 kJ·mol-1,B项不正确;稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1,C项错误;由于浓硫酸稀释时放出热量,故浓硫酸与稀NaOH溶液反应生成1 mol水,放出热量大于57.3 kJ。答案为D项。
本题难度:简单
2、选择题 下列物质既含有离子键又含有共价键的是
A.H2O
B.Na2O
C.NH4Cl
D.N2
参考答案:C
本题解析:A.H2O只有共价键;B.Na2O只有离子键;C.NH4Cl中NH与Cl-之间是离子键、NH内部N与H之间是共价键;D.N2只有共价键。
本题难度:简单
3、选择题 下列有关能量的描述及热化学反应方程式表示不正确的是
A.表示氢气燃烧热的热化学方程式为:H2(g) + 1/2 O2(g) = H2O(l);ΔH= -258.8 kJ ?mol-1
B.化学上把在稀溶液中,酸与碱发生中和反应生成1mol水时的反应热称为中和热。中和热可以用量热计直接测量
C.已知C(石墨) +O2(g) = CO2(g) ΔH="-393.5" kJ ?mol-1;
CO(g) + 1/2 O2(g) = CO2(g) ΔH="-283.0" kJ ?mol-1
则C(石墨)+1/2O2 (g)="CO(g)" ΔH="-110.5" kJ ?mol-1
D.关于“盖斯定律:‘一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的’。”可以理解为“一个反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关”。
参考答案:B
本题解析:A、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示氢气燃烧热的热化学方程式为:H2(g) + 1/2 O2(g) = H2O(l);ΔH= -258.8 kJ ?mol-1,A正确;B、化学上把在稀溶液中,酸与碱发生中和反应生成1mol水时的反应热称为中和热。中和热并能用量热计直接测量,B错误;C、已知① C(石墨) +O2(g) = CO2(g) ΔH="-393.5" kJ ?mol-1;②CO(g) + 1/2 O2(g) = CO2(g) ΔH="-283.0" kJ ?mol-1,则根据盖斯定律可知①-②得到C(石墨)+1/2O2 (g)="CO(g)" ΔH="-110.5" kJ ?mol-1,C正确;D、关于“盖斯定律:‘一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的’。”可以理解为“一个反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关”,D正确,答案选B。
考点:考查反应热的有关判断、盖斯定律的应用等
本题难度:一般
4、选择题 下列物质中有极性共价键的是( )
A.单质碘
B.氯化镁
C.溴化钾
D.水
参考答案:A、非金属单质分子含有非极性共价键,故A错误;
B、氯化镁只含有离子键,故B错误;
C、溴化钾只含有离子键,故C错误;
D、水所含化学键为不同非金属原子之间形成的,为极性共价键,故D正确.
故选D.
本题解析:
本题难度:简单
5、填空题 由氢气和氧气反应生成1mol水蒸气放热241.8KJ。
(1)写出该反应的热化学方程式_______________________ 。
(2)若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的
△H=______________ kJ·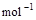 。
。
参考答案:( 4分)(1) H2(g) + 1/2O2(g) == H2O(g) △H=-241.8 kJ·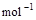 (2)-285.8
(2)-285.8
本题解析:(1)氢气和氧气反应生成1mol水蒸气放热241.8KJ,所以该反应的热化学方程式是H2(g) + 1/2O2(g) == H2O(g) △H=-241.8 kJ·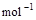 。
。
(2)若1g水蒸气转化成液态水时放热2.444KJ,则18g水蒸气转化成液态水时放热2.444KJ×18=43.992kJ,所以反应H2(g) + 1/2O2(g) == H2O(l)的△H=(-241.8-43.992)kJ/mol=-285.8 kJ/mol。
考点:考查热化学方程式的书写以及有关计算
点评:该题是基础性试题的考查,也是高考中的常见题型,难度不大。该题的关键是明确热化学方程式的含义以及书写的注意事项,然后灵活运用即可。有利于培养学生的规范答题能力。
本题难度:一般