时间:2020-07-28 05:56:35
1、选择题 下列反应属于放热反应的是
A.H2+CuO=Cu++H2O
B.C+CO2=2CO
C.CaO+H2O ===Ca(OH)2
D.C+H2O=CO+H2
参考答案:C
本题解析:一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以答案是C。
本题难度:简单
2、填空题 (2分)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和
液态水,已知室温下1g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是:
。
参考答案:SiO2(g)+2O2(g)=SiO2(s)+2H2O(l);ΔH=-1427.2KJ/mol(2分)
本题解析:略
本题难度:简单
3、选择题 已知:Fe2O3(s) + 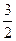 C(s) =
C(s) = 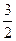 CO2(g) + 2 Fe(s)?ΔΗ="234.1" kJ·mol-1
CO2(g) + 2 Fe(s)?ΔΗ="234.1" kJ·mol-1
C(s) + O2(g) = CO2(g)?ΔΗ=-393.5 kJ·mol-1
则2 Fe(s)+ 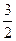 O2(g) = Fe2O3(s) 的ΔΗ是
O2(g) = Fe2O3(s) 的ΔΗ是
A.-824.4 kJ·mol-1
B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1
D.-169.4 kJ·mol-1
参考答案:A
本题解析: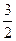 (2)=(1)就可得2 Fe(s)+
(2)=(1)就可得2 Fe(s)+ 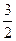 O2(g) = Fe2O3(s),则ΔΗ=
O2(g) = Fe2O3(s),则ΔΗ=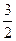 ΔΗ2-ΔΗ1=-824.4 kJ·mol-1。
ΔΗ2-ΔΗ1=-824.4 kJ·mol-1。
本题难度:一般
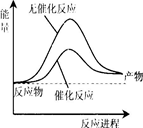
4、选择题 已知:N2(g)+3H2(g) 2NH3(l) △H=" -132" kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H=" -132" kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| | H2(g) | N2(g) | NH3(g) |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
参考答案:B
本题解析:A、反应是放热反应,反应物能量应高于生成物,故A错误;B、△H=反应物键能和-生成物键能和,有-132KJ/mol+40KJ/mol=946KJ/mol+3×436KJ/mol-6aKJ/mol,a=391KJ/mol,1mol氨气含有3molN-H键,故B正确;C、蒸发1mol NH3(l)需要吸收的能量为20kJ,N2(g)+3H2(g) 2NH3(l)△H=-132kJ/mol,2NH3(l)=2NH3(g)△H=+40KJ/mol,据盖斯定律可得:N2(g)+3H2(g)
2NH3(l)△H=-132kJ/mol,2NH3(l)=2NH3(g)△H=+40KJ/mol,据盖斯定律可得:N2(g)+3H2(g)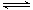 2NH3(g)△H=-92kJ/mol,1molN2(g)和3molH2(g)充分反应,但不能完全反应,所以Q<92,故C错误;D、催化剂只能加快反应速率,不影响反应热的大小,故D错误;故选B。
2NH3(g)△H=-92kJ/mol,1molN2(g)和3molH2(g)充分反应,但不能完全反应,所以Q<92,故C错误;D、催化剂只能加快反应速率,不影响反应热的大小,故D错误;故选B。
考点:考查放热反应的图象、利用键能求算反应热、可逆反应的反应热、盖斯定律的应用等
本题难度:一般
5、选择题 根据原子序数,下列各组原子能以离子键相结合的是:
A.2与8
B.6与16
C.8与14
D.9与11
参考答案:D
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。A中元素分别是He和O,不能形成化学键。B中分别是C和S,形成的是共价键。C中是O和Si,形成的是共价键。D中是F和Na,形成离子键,答案选D。
本题难度:一般