时间:2020-07-28 05:48:17
1、填空题 卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 ?区;氟原子的电子排布图为?溴原子的价电子排布式为?.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是?
(3)已知高碘酸有两种形式,化学式分别为H5IO6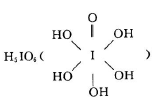 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为?。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为?。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 ?式发生。
A.CsICl2=CsCl+ICl? B.CsICl2 ="CsI" +Cl2
(5)ClO2-的空间构型为?型,中心氯原子的杂化轨道类型为?,写出一个ClO2-的等电子体 ?。
(6)如图为碘晶体晶胞结构。有关说法中正确的是?。
A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3.NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为?。
2、选择题 下列分子中,具有极性键的非极性分子的组合是
[? ]
A.H2、NH3、H2S
B.CS2、BF3、CO2
C.CH3Cl、CH2Cl、CH4
D.SO2、NO2、C2H2
3、选择题 下列说法错误的是( )
A.铅笔不含铅
B.水银不含银
C.白金不是金
D.火碱不是碱
4、选择题 下列有关化学用语使用正确的是( )
A.NH4Br的电子式: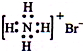
B.S2-的结构示意图: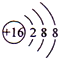
C.乙酸的分子式:CH3COOH
D.原子核内有l8个中子的氯原子:
5、选择题 下列哪一组元素的原子间反应可以形成离子键