时间:2020-07-28 05:44:20
1、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。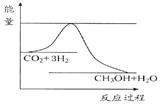
(1)关于该反应的下列说法中,其△H 0。(填“大于”、“小于”或“等于”), 且在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) (填“大于”“小于”或“等于”)乙容器内n(CH3OH)。
(5)已知:CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,写出CH3OH燃烧生成CO2和水蒸气的热化学方程式______________________________________。
(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为 。
②若以石墨为电极,电解硫酸铜溶液,写出电解的总反应方程式 。若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,当消耗1.6甲醇时,在阴极会析出 g铜。
参考答案:(1)小于 较低 (2)K=c(CH3OH)·c(H2O)/[c(CO2)·c3(H2)]
(3)增大 (2分) (4)等于(2分)
(5)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1302kJ/mol(2分)
(6)①CH3OH+8OH- - 6e-=CO32- + 6H2O,② 2Cu2++2H2O=Cu+O2↑+4H+, 9.6
本题解析:(1)根据该反应的能量关系图知,反应物的总能量大于生成物的总能量,该反应为放热反应,△H小于0;该反应正向为气体物质的量减小的放热反应,ΔH<0,ΔS<0;根据化学反应方向的判据ΔH —TΔS,若该反应自发进行,则有ΔH —TΔS<0,在较低温度下有利于该反应自发进行;(2)根据题给反应方程式知,该反应平衡常数K的表达式为K=c(CH3OH)·c(H2O)/[c(CO2)·c3(H2)];(3)该反应为放热反应,温度降低,平衡正向移动,平衡常数K增大;(4)根据等效平衡知识知,在一定条件下的可逆反应,无论反应从正向开始,还是从逆向开始,只要最初加入的物质的量相当,就会达到同一平衡状态,则达到平衡时,甲容器内n(CH3OH)等于乙容器内n(CH3OH);(5)已知:①CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;②CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;③H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,根据盖斯定律知,②×2+③×4—①×2,得CH3OH燃烧生成CO2和水蒸气的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH="-1302kJ/mol" ;(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。①原电池负极发生氧化反应,甲醇在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OH+8OH- - 6e- =CO32- + 6H2O,②若以石墨为电极,电解硫酸铜溶液,电解的总反应方程式2Cu2++2H2O=2Cu+O2↑+4H+,若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,1.6g甲醇的物质的量为0.05mol,根据电极反应式知,转移的电子为0.3mol,根据电子守恒知,在阴极会析出铜0.15mol,质量为9.6g。
考点:考查化学反应与能量变化、盖斯定律、燃料电池和电化学计算。
本题难度:困难
2、选择题 已知下列数据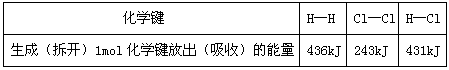
则下列热化学方程式不正确的是
[? ]
A.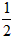 H2(g)+
H2(g)+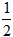 Cl2(g)==HCl(g) ;△H=-91.5kJ·mol-1
Cl2(g)==HCl(g) ;△H=-91.5kJ·mol-1
B.H2(g)+ Cl2(g)==2HCl(g) ;△H=-183kJ·mol-1
C.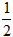 H2(g)+
H2(g)+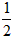 Cl2(g)==HCl(g) ;△H=+91.5kJ·mol-1
Cl2(g)==HCl(g) ;△H=+91.5kJ·mol-1
D.2HCl(g) ==H2(g)+ Cl2(g);△H=+183kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
[? ]
A.H2O(g)=H2(g)+1/2O2(g)ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g)ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1
参考答案:A
本题解析:
本题难度:简单
4、选择题 已知①2C(s)+O2(g) 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1
②2H2(g)+O2(g) 2H2O(g) ΔH="-483.6" kJ·mol-1
2H2O(g) ΔH="-483.6" kJ·mol-1
则反应C(s)+H2O(g) CO(g)+H2(g)的ΔH为( )
CO(g)+H2(g)的ΔH为( )
A.+131.3 kJ·mol-1
B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1
D.+262.6 kJ·mol-1
参考答案:A
本题解析:把方程式(①-②)/2,得出C(s)+H2O(g) CO(g)+H2(g) ΔH="(-221.0" kJ·mol-1+483.6 kJ·mol-1)/2="+131.3" kJ·mol-1,所以选A。
CO(g)+H2(g) ΔH="(-221.0" kJ·mol-1+483.6 kJ·mol-1)/2="+131.3" kJ·mol-1,所以选A。
本题难度:一般
5、简答题 Ⅰ.甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇:
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0kJ?mol-1
CO(g)+2H2(g)═CH3OH(g)△H=-129.0kJ?mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______.
(2)甲醇对水质会造成一定污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
①完成除去甲醇的离子方程式(方框内填化学式,横线上填计量数):______Co3++CH3OH+H2O═______+______Co2++______
②若如图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池负极的电极反应式:______.
Ⅱ.(1)NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)______.
(2)25℃时,将pH=x氨水与pH=y的硫酸(且x+y=14,x>11)等体积混合后,所得溶液中各种离子的浓度关系正确的是______.
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-)D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
参考答案:(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol
②CO(g)+2 H2(g)=CH3OH(g)△H=+129.0 kJ/mol
将方程式①-②得CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+206.0kJ/mol-(-129.0kJ/mol)=+77.0 kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0 kJ/mol;
(2)①甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,
故答案为:6;CO2↑;6;6H+;
②正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+H2O+4e-═4OH-,负极是甲醇失电子在建溶液中生成碳酸钾,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
Ⅱ、(1)氯化铵溶液中铵根离子水解溶液呈酸性,反应的离子方程式为:NH4++H2O?NH3?H2O+H+,故答案为:NH4++H2O?NH3?H2O+H+;
(2)X+Y=14,常温下某氨水的pH=X,则氨水中c(OH-)=10 X-14mol/L,某硫酸的pH=Y,硫酸中c(H+)=10-Ymol/L,所以氨水中c(OH-)等于硫酸中c(H+),一水合氨是弱电解质,硫酸是强电解质,所以氨水浓度大于硫酸,二者等体积混合,氨水过量,溶液呈碱性,
A.二者混合时,氨水过量,所以溶液呈碱性,则c(OH-)>c(H+),故A错误;
B.二者混合时,氨水过量,所以溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以2c(SO42-)<c(NH4+),离子浓度大小为c(NH4+)>c(SO42-)>c(OH-)>c(H+),故B正确;
C.任何溶液中都存在电荷守恒,根据电荷守恒得根据电荷守恒得c(NH4+)+c(H+)=2c(SO42-)+c(OH-),c(NH4+)+c(H+)>c(SO42-)+c(OH-),故C正确;
D.二者混合时,氨水过量,所以溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以2c(SO42-)<c(NH4+),故D错误;
故答案为:BC.
本题解析:
本题难度:简单