时间:2020-07-28 05:36:40
1、选择题 下列反应的离子方程式正确的是
A.在硫酸溶液中加入氢氧化钡溶液:H++OH-=H2O
B.氨水跟盐酸反应:H++OH-═H2O
C.碳酸钡溶于硝酸:BaCO3+2H+═Ba2++H2O+CO2↑
D.铁和硫酸铜溶液:2Fe+Cu2+=2Fe3++Cu
参考答案:C
本题解析:分析:A.漏写生成硫酸钡的离子反应;
B.一水合氨应保留化学式;
C.反应生成硝酸钡、水、二氧化碳;
D.反应生成硫酸亚铁和Cu.
解答:A.在硫酸溶液中加入氢氧化钡溶液的离子反应为Ba2++SO42-+2H++2OH-=2H2O+BaSO4↓,故A错误;
B.氨水跟盐酸反应的离子反应为NH3.H2O+OH-═H2O+NH4+,故B错误;
C.碳酸钡溶于硝酸的离子反应为BaCO3+2H+═Ba2++H2O+CO2↑,故C正确;
D.铁和硫酸铜溶液的离子反应为Fe+Cu2+=Fe2++Cu,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答的关键,注意离子反应中保留化学式的物质,题目难度不大.
本题难度:困难
2、选择题 下列关于化学理论学习和研究的说法错误的是( )
A.化学键的变化不一定会引起化学反应的变化
B.外界条件改变一定会引起化学反应的快慢变化
C.化学模型的建立有助于解释一些化学现象
D.化学基本原理的应用是建立在有一定条件的基础上的
参考答案:A.因有化学键断裂的变化中不一定有化学键生成,如HCl溶于水,故A正确;
B.对于没有气体参加的化学反应,改变压强对化学反应速率无影响,则外界条件改变不一定会引起化学反应的快慢变化,故B错误;
C.因化学模型较直观、易懂,则化学模型的建立有助于解释一些化学现象,如利用模型解释甲烷的结构,故C正确;
D.化学基本原理在一定条件下研究化学反应,如化学平衡移动原理在一定温度、压强下,故D正确;
故选B.
本题解析:
本题难度:一般
3、选择题 在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2
B.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2
C.C(s)+1/2O2(g)=CO(g),△H1;C(s)+O2(g)=CO2(g),△H2
D.S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2
参考答案:D
本题解析:A、氢气的燃烧是放热反应,焓变是负值,放出的热量越多,焓变越小。液态水变为气态水的过程是吸热的,故△H1>△H2,错误;B、氢气与氯气生成氯化氢的反应为放热反应,焓变是负值,放出的热量越多,焓变越小。化学反应方程式的系数加倍,焓变数值加倍,即2△H1=△H2,△H1>△H2,错误; C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,放热反应焓变是负值,放出的热量越多,焓变越小,△H1>△H2,错误;D、硫的燃烧反应是放热反应,焓变是负值,放出的热量越多,焓变越小,固体硫变为气态硫需要吸收热量,所以△H2>△H1,正确。
考点:考查反应热大小比较。
本题难度:一般
4、选择题 已知:H+(aq)+ OH-(aq)
参考答案:
本题解析:
本题难度:一般
5、填空题 用50mL 0.50 mol?L-1盐酸与50mL 0.55 mol?L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: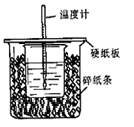
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热△H绝对值 。(填偏大、偏小、无影响)
参考答案:(6分)(1)环形玻璃搅拌棒(2) 保温、隔热,减小热量散失对实验造成的影响(3)偏小
本题解析:(1)由于反应中需要搅拌,所以从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒。
(2)该实验中要尽可能的减少热量的损失,所以烧杯间填满碎纸条的作用是保温、隔热,减小热量散失对实验造成的影响。
(3)大烧杯上如不盖硬纸板,则会导致热量的损失,所以求得的中和热△H绝对值偏小。
考点:考查中和热测定的有关实验判断
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练,有利于调动学生的学习兴趣,激发学生的学习积极性。该题主要是常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般