时间:2020-07-28 05:25:26
1、选择题 摩尔是( )
A.国际单位制的一个基本物理
B.计量微观粒子的物质的量的单位
C.表示物质质量的单位
D.表示6.02×1023个粒子的集体
2、实验题 (9分)下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 。
③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是 (填字母)。
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E、未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 mol/L。
a.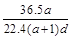 b.
b.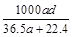 c.
c.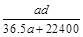 d.
d.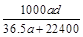
3、选择题 用NA表示阿伏加德罗常数,1mol SO2分子中含有氧原子数为
A.NA
B.2NA
C.3NA
D.4NA
4、选择题 将20?mL?0.5?mol/L?Al2(SO4)3溶液加水稀释到500?mL,稀释后溶液中SO42-浓度为( )
A.0.01?mol/L
B.0.02?mol/L
C.0.03mol/L
D.0.06mol/L
5、简答题 配制0.1mol/L氢氧化钠溶液450mL,请按操作顺序[①、②、③…]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字.
______在盛有氢氧化钠的烧杯中注入一定的蒸馏水,用玻璃棒搅拌,使其溶解.
______待溶解的氢氧化钠溶液冷却后,沿玻璃棒注入______?mL的容量瓶中.
______用天平称取氢氧化钠______?克,放入烧杯中.
______用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中.
______往容量瓶中小心加入蒸馏水至液面接近刻度______cm处,改用______?加蒸馏水.至溶液液面恰好______.