时间:2020-07-28 05:23:02
1、选择题 钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好。而负极的活性物质是液态金属钠。正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子。下列有关钠氯化镍蓄电池的说法错误的是
A.电池放电时的总反应为2Na+NiCl2===Ni+2NaCl
B.充电时阳极的电极反应为Na++e-===Na
C.放电时正极的电极反应为Ni2++2e-===Ni
D.该电池被称为绿色电池,最大原因是从废弃电池中可以方便地回收较纯的镍,其他产物对环境没有影响
参考答案:B
本题解析:该蓄电池放电时,负极反应为Na-e-===Na+,正极反应为Ni2++2e-===Ni,总反应式为2Na+NiCl2===Ni+2NaCl,故A、C正确;充电时,阴极电极反应为Na++e-===Na,故B错误。
点评:本题考查了蓄电池充放电时的电极反应,明确电池的正负极以及发生的反应是解题的关键。难度不大
本题难度:简单
2、选择题 日本产业技术综合研究所最近研发了一种新型的锂空气电池,它既可用作充电电池又可作锂燃料电池。用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可回收锂而循环使用。下列叙述不正确的是 
[? ]
A.放电时负极的电极反应式为:Li-e-=Li+
B.充电时,阳极的电极反应式为:2H2O+O2+4e-=4OH-
C.充电时,锂极与外电源的负极相连
D.熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂
参考答案:B
本题解析:
本题难度:一般
3、选择题 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是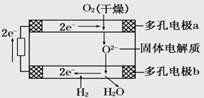
A.有O2放电的a极为电池的负极
B.O2-移向电池的正极
C.b极对应的电极反应为2H2-4e-+2O2-==2H2O
D.a极对应的电极反应为O2+2H2O+4e-==4OH-
参考答案:C
本题解析:A、电子流向a电极,因此a电极正极,A错误;B、原电池中阴离子向负极移动,则O2-移向电池的负极,B错误;C、b电极是正极,氢气得到电子,电极反应式为2H2-4e-+2O2-==2H2O,C正确;D、a极是负极,氧离子失去电子,电极反应为2O2——4e-==O2↑,D错误,答案选C。
考点:考查原电池原理的应用
本题难度:一般
4、选择题 获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是( )
A.该电池负极的电极反应为:Al-3e-═Al3+
B.电池工作时,溶液中的铝离子向正极移动
C.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多
D.该电池可能是一种可充电的二次电池
参考答案:A.因Al元素的化合价升高,则电池负极的电极反应为Al-3e-═Al3+,故A正确;
B.原电池中阳离子向正极移动,则电池工作时,溶液中的铝离子向正极移动,故B正确;
C.因Al的摩尔质量为27g/mol,由mM×失去的电子数可知,消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多,故C正确;
D.该反应的逆过程不能发生,所以该电池为一次电池,故D错误;
故选D.
本题解析:
本题难度:简单
5、计算题 (6分)在标准状况下,将224L HCl气体溶于635mL水中,所得盐酸的密度为1.18g/cm3。
试计算:
(1) 所得盐酸的质量分数和物质的量浓度
所得盐酸的质量分数和物质的量浓度
(2)取出这种盐酸100mL,稀释至1.18L,所得稀盐酸的物质的量浓度。
参考答案: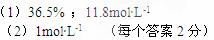
本题解析:略
本题难度:简单