时间:2020-07-28 05:22:42
1、选择题 短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10.A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是( )
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物的熔点比C的氧化物高
D.A与C可形成离子化合物
参考答案:B原子最外层电子数等于A原子次外层电子数,则B的最外层电子数为2,根据它们的原子的最外层电子数之和为10.A与C在周期表中同主族,可知A、C的最外层电子数为4,故A为C元素、C为Si元素,A、B、C原子序数依次递增,则B为Mg元素,
A、A为C元素,B为Mg元素,C为Si元素,同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,所以原子半径为Mg>Si>C,故A错误;
B、同主族自上而下非金属性减弱,非金属性越强,氢化物的越强,非金属性C>Si,A的氢化物的稳定性大于C的氢化物,故B正确;
C、A的氧化物为分子晶体,C的氧化物为原子晶体,C的氧化物的熔点比A的氧化物高,故C错误;
D、A与C形成的化合物为SiC,为共价化合物,故D错误.
故选:B.
本题解析:
本题难度:简单
2、选择题 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则正确的是( )
A.原子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
参考答案:AD
本题解析:
本题难度:简单
3、选择题 在短周期中,由质子数为a,M层上电子数是b?(a、b均大于0)的原子构成的单质X,与盐酸反应有可燃性气体生成.则下列说法中不正确的是( )
A.单质X一定是金属
B.单质X不可能与强碱反应
C.a=b+10
D.b<4
参考答案:B
本题解析:
本题难度:一般
4、选择题 如图中曲线表示原子序数在前20号中的某些元素的原子序数(按递增顺序连续排列)和单质沸点的关系,其中A点表示的元素是( )
A.Si
B.Al
C.S
D.F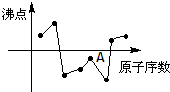
参考答案:根据气体的沸点都低于0℃,可推断A为一种气体.
A、Si单质为非金属固体,不符合条件,故A错误;
B、Al单质为金属固体,不符合条件,故B错误;
C、S单质为非金属固体,不符合条件,故C错误;
D、F的单质为气态,故D正确.
故选:D.
本题解析:
本题难度:一般
5、填空题 A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18.其中A与C、B与E分别为同族元素.原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等.回答下列问题:
(1)A______B______(用元素符号表示)
(2)D的最高价氧化物对应水化物的化学式为______.
(3)C与E组成的常见化合物的电子式为______.
参考答案:B原子最外层电子数是次外层的3倍,应为O元素,B与E分别为同族元素,则E为S元素,C、D的核外电子数之和与B、E核外电子数之和相等,原子半径A<B<E<D<C,则C应为Na元素,D为Al元素,二者核外电子数之和为24,A的原子半径最小,且A与C同主族,则A为H元素,
(1)由以上分析可知A为H元素,B为O元素,故答案为:H;O;
(2)D为Al元素,D的最高价氧化物对应水化物的化学式为Al(OH)3,故答案为:Al(OH)3;
(3)C与E组成的常见化合物为Na2S,为离子化合物,电子式为
,
故答案为:
.
本题解析:
本题难度:一般