时间:2020-07-28 05:18:24
1、简答题 下面是你熟悉的物质O2、HCl、H2O、NaOH、MgCl2
(1)这些物质中,只含共价键的是______;只含离子键的是______;
(2)既含共价键又含离子键的是______;NaOH的电子式为:______.
参考答案:(1)活泼金属和活泼非金属之间易形成离子键,非金属之间易形成共价键(铵盐除外),所以O2、HCl、H2O只含共价键;?MgCl2中镁离子和氯离子之间只存在离子键,所以只含离子键,故答案为:O2、HCl、H2O;MgCl2;
(2)NaOH中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,所以氢氧化钠中既有离子键又有共价键;NaOH为离子化合物,其电子式为
,
故答案为:NaOH;
.
本题解析:
本题难度:一般
2、选择题 下列分子中,所有原子的最外层均为8电子结构的是(?)。
A.BeCl2
B.H2S
C.NCl3
D.PCl5
参考答案:
本题解析:略
本题难度:简单
3、填空题 化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2 (g)和O2 (g) 生成NO(g)过程中的能量变化:?
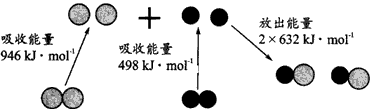
参考答案:(1)946 ;N2(g)+O2(g)=2NO(g) △H= +180kJ·mol-1
(2)2NO(g)=N2(g)+O2(g)△H=-180 kJ·mol-1 ;90
本题解析:
本题难度:一般
4、选择题 下列变化不需要破坏化学键的是( )
A.干冰气化
B.HCl溶于水
C.NaCl溶于水
D.SiO2熔化
参考答案:A.干冰气化破坏的是分子间作用力,不破坏化学键,故A选;
B.HCl溶于水破坏共价键,故B不选;
C.NaCl溶于水破坏离子键,故C不选;
D.SiO2熔化时破坏共价键,故D不选;
故选A.
本题解析:
本题难度:一般
5、填空题 (10分)有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大?②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
| 化学键 | F—D | F—F | B—B | F—B | C—D | D—D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
参考答案:(1)NaHCO3 CH3COONa(或其他有机酸的盐)? (2)3 2 (3)-990.7 kJ/mol
本题解析:根据E元素的电离能可判断,E是第IA。又因为的E的原子序数仅小于F的,所以E是钠元素。则D是氧元素,所以A是氢元素,B是碳元素,C是氮元素,F是硅元素。
(1)有H、C、O、Na形成的无水盐是NaHCO3和CH3COONa(或其他有机酸的盐)。
(2)乙炔分子中还有碳碳三键,因为单键全部是σ键,三键是由1个σ键和2个π键构成的。是由乙炔分子中含有3个σ键和2个π键。
(3)硅燃烧的化学方程式为Si+O2 SiO2,所以根据反应热的概念可知,该反应的反应热是
SiO2,所以根据反应热的概念可知,该反应的反应热是
176kJ/mol×2+497.3kJ/mol- 460kJ/mol×4=-990.7 kJ/mol。
本题难度:一般