时间:2020-07-28 05:02:57
1、选择题 标准状况下,11.2升二氧化碳气体的质量是 ( )
A.11克
B.22克
C.44克
D.5.6克
参考答案:B
本题解析:略
本题难度:一般
2、填空题 12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 gCO2。测得有机化合物A的蒸气对H2的相对密度是30,求: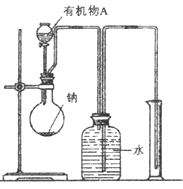
(1)有机物A的分子式 。
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为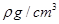 )的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
参考答案:(1)C3H8O(2分)
(2)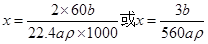 (其它部分化简的表达式均可得分)(2分)
(其它部分化简的表达式均可得分)(2分)
本题解析:(1)根据阿伏加德罗定律可知,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,则该化合物的相对分子质量为30×2=60,则12g有机物的物质的量是
12g÷60g/mol=0.2mol
n(H2O)=14.4g÷18/mol=0.8mol
n(CO2)=26.4g÷44/mol=0.6mol
所以12.0g有机物中含有:m(C)=0.6mol×12g/mol=7.2g
m(H)=2×0.8mol×1g/mol=1.6g
则m(O)==12.0g-7.2g-1.6g=3.2g
n(O)=3.2g÷16g/mol=0.2mol
所以有机物中含有:N(C)=3,N(H)=8,N(O)=1
则有机物分子式为C3H8O
(2)amL(密度为ρg/cm3)的有机物A的质量为:m=aρg
物质的量为:aρg÷60g/mol=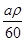 mol
mol
量筒液面读数为bml,即生成氢气的体积为bml
则n(H2)=0.001bL÷22.4L/mol
则C3H8O+xNa C3H(8-x)ONa+0.5xH2
C3H(8-x)ONa+0.5xH2
1 0.5x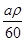 mol
mol 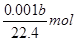
解之得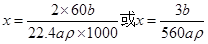
考点:考查有机物分子式的确定
点评:该题是基础性试题的考查,试题贴近教材,紧扣基础,有利于调动学生的学习兴趣和学习积极性,难度不大。该题的关键是根据原子守恒法来解答,有助于培养学生的规范答题能力。
本题难度:一般
3、选择题 将1mol NaOH溶于水中,配制成1 L溶液,则该溶液的物质的量浓度为
A.0.1 mol/L
B.0.5 mol/L
C.4 mol/L
D.1 mol/L
参考答案:D
本题解析:根据C="n/V" 得C="1mol/1L=1" mol/L,选D。
考点:考查物质的量浓度的有关计算。
本题难度:一般
4、选择题 在相同温度和压强下,4个容器中分别装有4种气体,已知各容器中的气体和容器的容积分别是a.CO2,100 mL;b.O2,200 mL;c.N2,400 mL;d.CH4,600 mL,则4个容器中气体的质量由大到小的顺序是 (?)
A.a>b>c>d
B.b>a>d>c
C.c>d>b>a
D.d>c>a>b
参考答案:C
本题解析:设在该温度和压强下,气体的气体摩尔体积为Vm,a容器内气体的质量为:m(CO2)="0.1L×44g/mol÷Vm" mL/mol="4.4/" Vm g;b容器内气体的质量为:m(O2)="0.2L×32g/mol÷Vm" mL/mol="6.4/" Vm g ;c容器内气体的质量为:m(N2)="0.4L×28g/mol÷Vm" mL/mol="11.2/" Vm g;d容器内气体的质量为:m(CH4)="0.6L×16g/mol÷Vm" mL/mol="9.6/" Vm g;则4个容器中气体的质量由大到小的顺序是c>d>b>a。故选C.
本题难度:一般
5、选择题 某500mL溶液中含有0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
[? ]
参考答案:C
本题解析:
本题难度:一般