时间:2020-07-28 05:02:16
1、选择题 咖啡因(化学式为C8H10N4O2)能兴奋中枢神经、消除疲劳。(1)咖啡因属那一类别的物质 (填“有机物”或“无机物”)其摩尔质量为 .(2)若一杯咖啡含0.194克咖啡因那这杯咖啡中有 个咖啡分子。
参考答案:(1)有机物 194g/mol (2) 6.02×1020.
本题解析:含有碳元素的化合物是有机物。咖啡因C8H10N4O2含有碳元素,属于有机化合物。C8H10N4O2的相对分子质量为194,所以其摩尔质量为194g/mol.n(C8H10N4O2)=m/M=0.194g÷194g/mol=0.01mol.所以N=n·NA=0.01mol×6.02×1023个/mol=6.02×1020个。
考点:考查有机化合物、摩尔质量、相对分子质量、微粒数的概念及相互关系的知识。
本题难度:一般
2、选择题 下列物质:① 1.7g NH3;②标准状况下22.4L CH4气体;③4℃时9mLH2O;④0.2mol CH3 CH2OH按所含的氢原子数由多到少的顺序排列正确的是:
A.②④③①
B.④③②①
C.②③④①
D.无法判断
参考答案:A
本题解析:①1.7g,0.1molNH3中的H原子数为0.1×3×NA=0.3NA,
②标准状况下CH4的物质的量为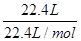 =1mol,其原子数为l×4×NA=4NA,
=1mol,其原子数为l×4×NA=4NA,
③水的质量为9mL×1g·mL-1=9g,其物质的量为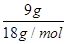 =0.5mol,则原子数为0.5×2×NA=1NA,
=0.5mol,则原子数为0.5×2×NA=1NA,
④0.2molH3PO4中的H原子数为0.2×3×NA=0.6NA,
显然所含的H原子数由多到少的顺序②④③①,选A
本题难度:一般
3、计算题 (4分)已知CO和CO2的混合气体14.4g在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为?g,CO2的物质的量为?mol
参考答案:5.6; 0.2
本题解析:设CO质量为xg,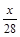 +
+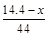 =
=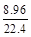 ,x=5.6。二氧化碳质量为8.8g,物质的量为0.2mol。
,x=5.6。二氧化碳质量为8.8g,物质的量为0.2mol。
点评:物质的量计算公式的灵活运用。
本题难度:一般
4、选择题 在100 mL某混合溶液中,c(HNO3) =" 0.4" mo/lL、c(H2SO4) =" 0.1" mol/L,向其中加入1.92 g Cu粉,微热充分反应后溶液中的c(Cu2+)为 ( )
A.0.15mol/L
B.0.225mo1/L
C.0.3mo1/L
D.无法计算
参考答案:B
本题解析:略
本题难度:一般
5、选择题 向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量为
A.小于0.45 mol
B.等于0.45 mol
C.在0.45~0.90 mol之间
D.大于0.45 mol
参考答案:A
本题解析:析:根据浓硫酸与铜反应,随着反应的进行,浓硫酸变稀,稀硫酸与铜不反应,浓硫酸与铜反应时被还原的H2SO4为参加反应的浓硫酸的一半.
解答:解:Cu+2H2SO4(浓)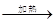 CuSO4+SO2↑+2H2O,被还原的硫酸的物质的量理论上应是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,
CuSO4+SO2↑+2H2O,被还原的硫酸的物质的量理论上应是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,
则50mL?18mol/LH2SO4溶液中加入足量的铜片并加热后被还原的硫酸的物质的量应为:小于0.45mol.
故答案为:A.
本题难度:简单