时间:2020-07-28 04:57:41
1、填空题 (15分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是?。(选填字母)
A.电解水
B.锌和稀硫酸反应
C.光解海水
D.分解天然气
(2)用水分解获得氢气的能量变化如右图所示,表示使用催化剂是曲线?。该反应为?(放热还是吸热)反应
(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量写出其完全燃烧的热化学方程式:?。
(4)利用氢气和CO合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  ?CH3OH(g);ΔH =-90.8 kJ·mol-1
?CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  ?CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
?CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  ?CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
?CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  ?CH3OCH3(g) + CO2 (g)的ΔH=?
?CH3OCH3(g) + CO2 (g)的ΔH=?
(5)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:
①氢氧燃料电池中,正极的电极反应式为?。
②上图装置中,某一铜电极的质量减轻3.2g,则 a 极上消耗的O2在标准状况下的体积为
?L。
(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。则正极电极方程式?。
参考答案:20.(15分)
(1)C?(2)b?吸热
(3)2H2(g)+O2(g)=2H2O(l) △H= -571.6 kJ·mol-1
(4)-246.4kJ· mol -1?(5)①O2+2H2O+4e-=4OH-?② 0.56?
(6)N2+6e-+8H+=2NH4+?((1)1分,其余每空2分)
本题解析:1、电解水消耗了大量的电力,锌和稀硫酸反应制得氢气量少,分解天然气也需要消耗大量的能源。?光解海水只需要太阳能就可以了既经济又环保。
2、使用催化剂能降低反应需要的能量,所以为b,生成物的能量高于反应物能量,所以反应为吸热反应。
4、总反应为2①+②+③,将反应热相加即可算出总反应的反应热。
5、氢氧燃料电池氧气在正极进行反应,O2+2H2O+4e-=4OH-?根据铜减少的质量可以计算出其转移的电子数,根据正极的反应式就可以算出消耗氧气的量。
6、正极为氮气反应式为N2+6e-+8H+=2NH4+
点评:本题难度中等,主要考察了氢氧燃料电池的原理及运用,采用类比的思想更能迅速准确的解题。
本题难度:一般
2、选择题 某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O
参考答案:①、由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故①错误;
②、充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,故②正确;
③、充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,Ni(OH)2做阳极,故③正确.
④、根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,所以电解质溶液是碱,故④正确;
故选D.
本题解析:
本题难度:一般
3、选择题 ?“纸质电池”于2006年被美国《时代》周刊评为年度8大最佳创新技术之一。这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为: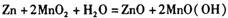 关于此电池,下列说法正确的是
关于此电池,下列说法正确的是
A.电子从MnO2通过外电路流向
B.该电池的正极反应为: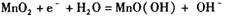
C.每转移0.1mol电子,消耗了 6.5g Zn
D.电池工作时OH-能通过薄层纸片向附着二氧化锰的电极移动
参考答案:B
本题解析:略
本题难度:一般
4、选择题 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
A.装置X每消耗1mol?H2O,就可为燃料电池提供22.4?L燃料
B.该系统中最多存在3种形式的能量转化
C.装置Y中正极的电极反应式为:O2+2H2O+4e-→4OH-
D.装置X、Y形成的子系统实现了物质的零排放,并能实现化学能与电能间的完全转化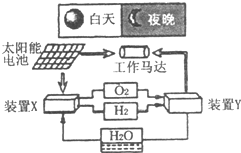
参考答案:A、装置X每消耗1molH2O,可生成1molH2,0.5molO2,共1.5mol,体积为33.6L,故A错误;
B、存在能量转化形式有太阳能、机械能、化学能、电能,则不只是三种,故B错误
C、装置Y为燃料电池,氧气在正极得电子被还原,电极反应式是:4OH--4e-=2H2O+O2↑,故C正确;
D、在装置X中,电解水生成H2、O2,实现了电能与化学能的转化;在装置Y中构成燃料电池,化学能转化为电能,作用于马达实现了电能与机械能的转化,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是
[? ]
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为O2+2H2O+4e- = 4OH-
D.该电池的总反应方程式为
参考答案:D
本题解析:
本题难度:一般