时间:2020-07-28 04:52:29
1、选择题 水的电离平衡曲线如图所示.下列说法正确的是( )
A.图中对应点的温度关系为:a>b
B.水的电离常数KW数值大小关系为:b>d
C.温度不变,加入少量NaOH可使溶液从c点变到a点
D.在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
参考答案:B
本题解析:
本题难度:简单
2、选择题 以下电离方程式书写正确的是
A.H2S2H++S2-
B.CaCO3=Ca2++CO32-
C.NaHCO3Na++HCO3-
D.NaHS=Na++H++S2-
参考答案:B
本题解析:分析:用化学式和离子符号表示电离过程的式子,称为电离方程式,离子所带电荷数一般可根据它们在化合物中的化合价来判断,在电离方程式中,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆.
解答:A、氢硫酸是分步电离的,电离方程式为:H2S H++HS-,HS-
H++HS-,HS- H++S2-,故A错误;
H++S2-,故A错误;
B、碳酸钙是强电解质,能完全电离出钙离子和碳酸根离子,即CaCO3=Ca2++CO32-,故B正确;
C、碳酸氢钠能完全电离出钠离子和碳酸氢根离子,即NaHCO3=Na++HCO3-,故C错误;
D、硫氢化钠能完全电离出钠离子和硫氢根离子,即NaHS=Na++HS-,故D错误.
故选B.
点评:在解此类题时,首先分析应用的原理是否正确,然后再根据电离方程式的书写规则进行判断,难度不大.
本题难度:一般
3、选择题 FeCl3水解平衡为:Fe3++3H2O Fe(OH)3+3H+;若要使c(Fe3+)降低,且pH值增大的方法是
Fe(OH)3+3H+;若要使c(Fe3+)降低,且pH值增大的方法是
A.降低温度
B.通入少量HCl气体
C.加入少量Fe粉
D.加入适量蒸馏水
参考答案:CD
本题解析:降低温度,平衡左移,c(Fe3+)增大,故A错误;通入少量HCl气体,pH值减小,故B错误;加入少量Fe粉,发生反应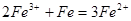 ,c(Fe3+)降低,水解平衡左移,pH值增大,故C正确;加入适量蒸馏水,c(Fe3+)、c(H+)都减小,故D正确。
,c(Fe3+)降低,水解平衡左移,pH值增大,故C正确;加入适量蒸馏水,c(Fe3+)、c(H+)都减小,故D正确。
考点:本题考查盐的水解。
本题难度:一般
4、实验题 (10分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中定容成250 mL烧碱溶液;
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) 

 D
D  。
。
(2)操作D中液面应调整到 。
(3)滴定终点的现象是 。
(4)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(5)该烧碱样品的纯度计算式是 。
参考答案:
(1)C;A;B;D;E;
(2)零刻度或零稍下的某一刻度(不完整不给分)
(3)由黄色变为橙色,且半分钟不变色
(4)偏高
(5)80(V2-V1)c/m %
本题解析:(1)正确操作步骤的顺序是C.称取品m g,溶解;配成成250 mL烧碱溶液;移取25 mL烧碱溶液,滴加指示剂;将标准H2SO4溶液装入滴定管,调整液面,记下开始刻度为;在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度。
(2)零刻度以上不能读数,操作D中液面应调整到零刻度或零稍下的某一刻度 。
(3)甲基橙作指示剂,用酸滴定碱,溶液从碱性滴定到终点,滴定终点的现象是由黄色变为橙色,且半分钟不变色 。
(4)若酸式滴定管没有用标准H2SO4润洗,标准H2SO4溶液被稀释,所用H2SO4溶液的体积会偏大,测定结果偏高。
(5)所用硫酸的体积为(V2-V1)/1000L,物质的量为cmol/L×(V2-V1)/1000L,所测氢氧化钠的物质的量为2cmol/L×(V2-V1)/1000L,烧碱样品中氢氧化钠的质量为[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml),该烧碱样品的纯度计算式是[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml)÷mg×100%= 80(V2-V1)c/m %。
考点:酸碱中和滴定的操作及计算
本题难度:一般
5、填空题 (1)工业上合成氨的反应方程式为______,反应是在______中进行,该设备的出口处的气体是______(填写分子式).
(2)纯水中含有10电子的粒子有______种.
(3)向氢氧化钠溶液中逐渐加入盐酸至中性的过程中,水的电离程度______(填增大、减小、不变).
(4)将1mol/L的氯化铁溶液和3mol/L的硫氰化钾溶液等体积混合,所得溶液中K+的物质的量浓度为______mol/L.
(5)用润湿的pH试纸测得的0.01mol/LNaOH溶液的pH______12(填<、>、=).
参考答案:(1)工业合成氨的反应是可逆反应,不能进行到底,即最终得到的反应体系中既有反应物又有生成物,该反应需要一定的温度、压强和催化剂.
因此,合成氨的反应方程式为:N2+3H2高温、高压
本题解析:
本题难度:一般