时间:2020-07-28 04:46:14
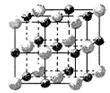
1、选择题 已知食盐晶体的密度为ρg·cm-3,若下图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为 
[? ]
A.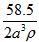
B.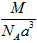
C.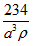
D.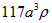
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列物质中,属于离子晶体的是
A.铜
B.蒸馏水
C.石墨
D.食盐晶体
参考答案:D
本题解析:离子化合物才能形成离子晶体,氯化钠是离子化合物,D正确。A是原子晶体,B形成的是分子晶体,石墨属于混合型晶体。答案选D。
本题难度:简单
3、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
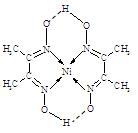
参考答案:(1)>(2分)
(2)TiN>MgO>CaO>KCl(2分,有1项排错即给0分)? 12(2分)
(3)CrO2(2分)
(4)sp2(2分)?[Ar]3d74s2(2分)
本题解析:略
本题难度:一般
4、选择题 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为 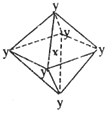
[? ]
A.NaCl?
B.CsCl
C.CO2?
D.SiO2
参考答案:A
本题解析:
本题难度:一般
5、选择题 水分子间可通过一种叫“氢键”的作用(介于化学键和范德瓦耳斯力大小之间),彼此结合而形成(H2O)n,在冰中的n值为5。即每个水分子都被其他4个水分子包围形成变形四面体,如图1-11所示为(H2O)5单元,由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体,即冰。下列有关叙述正确的是(?)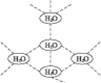
图1-11
A.1 mol冰中有4 mol氢键
B.1 mol冰中有4×5 mol氢键
C.平均每个水分子只有2个氢键
D.平均每个水分子只有5/4个氢键
参考答案:C
本题解析:在冰中每个水分子被4个水分子包围,即每2个水分子间存在一个氢键,每个氢键为2个水分子共用,在一个氢键中,每个水分子平均拥有1/2个氢键,而每个水分子可形成4个氢键,所以每个水分子平均含有氢键为:1/2×4=2个,也就是说1 mol冰中有2 mol“氢键”。
本题难度:简单