时间:2020-07-28 04:43:23
1、选择题 常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量(? )
A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-)
B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)
C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L
D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+)
参考答案:B
本题解析:A.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-).错误。B.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-);根据微粒的物质的量的关系可得C(Na+) =C(SO32-)+C(HSO3-) +C(H2SO3)。代入第一个式子,整理可得C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)。正确。C.混合后溶液中的微粒根据物料守恒关系可知: C(SO32-)+C(HSO3-)+C(H2SO3)=(0.01+0.01)÷2="0.01" mol/L.错误。D.两溶液混合前,在Na2SO3溶液中,由于SO32-是H2SO3二级电离产生的离子,而KHSO3溶液中HSO3-是H2SO3一级电离产生的离子,所以SO32-一级水解水解程度大于二级HSO3-的水解程度。水解程度越大,水电离产生的离子浓度越大。因此两溶液混合前,Na2SO3溶液中,水电离出C(H+)大于KHSO3溶液中水电离出C(H+)。错误。
本题难度:一般
2、选择题 常温下用pH试纸测定某溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=6。则此溶液的实际pH
A.大于6
B.小于6
C.等于6
D.大于7
参考答案:B
本题解析:pH试纸使用时不能用蒸馏水润湿,若润湿,会导致溶液浓度降低,对酸性溶液来说,润湿后PH=6,说明原溶液的氢离子浓度大,则PH<6,选B。
考点:考查PH试纸的使用。
本题难度:一般
3、选择题  在一定温度下,HCN在水中存在电离平衡:HCN
在一定温度下,HCN在水中存在电离平衡:HCN H+ + CN-。下列说法错误的
H+ + CN-。下列说法错误的 通入HCl气体,Q>K,平衡逆向移动
通入HCl气体,Q>K,平衡逆向移动
升高温度,溶液pH减小 稀释溶液,电离平衡常数减小
稀释溶液,电离平衡常数减小
D.加入NaCN固体,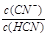 增大
增大
参考答案:C
本题解析:
答案:C
A、正确,通入HCl气体,H+浓度增大,平衡逆向移动;
B、正确,电离是吸热反应,升高温度,平衡正向移动,H+浓度增大,溶液pH减小
C、不正确,稀释溶液,电离平衡常数不变;
D、正确,CN―浓度增大的幅度大于HCN。
本题难度:简单
4、填空题 (8分)现有HA、HB、HC三种一元弱酸,分析并回答下列问题:
①等PH值的三种酸,加水稀释的PH值变化如图比较三种酸的酸性强弱?〉
?〉??三种酸的物质的量浓度由大到小的顺序?。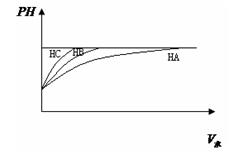
②同浓度的NaA, NaB, NaC,PH值的大小?〉?〉?。
③25℃时若已知NH4B的溶液显中性,则NH4A溶液的PH值??7,写出NH4C的水解的离子方程式?。
④PH=2的HA与PH=12的NaOH等体积混合后,溶液中离子浓度由大到小的顺序是?。
参考答案:(8分)
① HC 〉 HB 〉 HA(1分)
物质的量浓度由大到小的顺序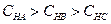 (1分)
(1分)
②PH值的大小 〉
〉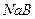 〉
〉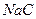 (2分)
(2分)
③PH值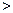 7 (1分)
7 (1分)
离子方程式 (1分)
(1分)
④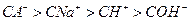 (2分)
(2分)
本题解析:略
本题难度:一般
5、填空题 称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上塞子,定时测定生成氢气的体积。甲加入50 mL pH=3的盐酸,乙加入50 mL pH=3的醋酸,丙加入50 mL pH=3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌。请用“>”“=”或“<”回答下列各题。
(1)开始时,反应速率的大小为 。
(2)三支试管中参加反应的锌的质量为 。
(3)反应终了,所需时间为 。
(4)在反应过程中,乙、丙速率不同的理由是(简要说明) 。
参考答案:(1)甲=乙=丙 (2)甲=乙<丙 (3)甲>乙>丙(4)因丙形成原电池,加快了反应速率。
本题解析:(1)开始时,四种溶液的pH相等,氢离子浓度相等,反应速率的大小为甲=乙=丙。(2)三支试管中生成氢气的体积一样多,丙中有少量锌和硫酸铜反应,参加反应的锌的质量为甲=乙<丙。(3)随着反应的进行,乙和丙中醋酸不断电离,氢离子浓度大于甲,丙中加入了胆矾,形成原电池,故反应速率:甲<乙<丙,所需时间为甲>乙>丙。(4)在反应过程中,乙、丙速率不同的理由是因丙形成原电池,加快了反应速率。
考点:考查强弱电解质的对比、影响反应速率的因素。
本题难度:一般