时间:2020-07-28 04:43:02
1、选择题 在密闭容器中进行如下反应:C(s)+ H2O(g)====CO(g)+H2(g),当改变下列条件时反应速率不会加快的是
A.升温
B.加压
C.充入H2O(g)
D.充入N2
参考答案:D
本题解析:升温会导致所有反应的速率加快;由于有气体参加反应,所以加压也会加快反应速率;充入H2O(g)会导致该物质的浓度增大,所以加入H2O(g)也会导致速率的加快;充入N2时由于密闭容器体积不变,各种气态物质的浓度不会改变,再加上N2和反应体系内所有的气态物质又不反应,此时反应速率不会受到影响。
本题难度:一般
2、选择题 下列关于热化学反应的描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.由C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则CH3COOH和NaOH反应的生成1mo水时放出的热量为57.3 kJ
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H =" +2×283.0" kJ/mol
参考答案:D
本题解析:A.吸热反应是指生成物成键释放的总能量小于反应物断键吸收的总能量,与是否加热无关,错误;B.根据C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ·mol-1可知,石墨比金刚石稳定,错误;C.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,错误;D.CO燃烧放热,则其逆反应吸热,正确;选D.
考点:考查热化学方程式、燃烧热、中和热等知识。
本题难度:一般
3、计算题 已知2H2(g)+O2(g) 2H2O(l) △H=-571.6kJ·mol-1?
2H2O(l) △H=-571.6kJ·mol-1?
C3H8(g)+5O2(g) 3CO2(g)+4H2O △H=-2 220 kJ·mol-1?
3CO2(g)+4H2O △H=-2 220 kJ·mol-1?
设有氢气和丙烷的混合气体5mol,完全燃烧时放出热量3847kJ,则混合气体中H2和丙烷的体积比。
A.1∶3
B.3∶1
C.1∶4
D.1∶1
参考答案:3∶1
本题解析:本题主要考查根据燃烧热计算反应物的组成。可以用三种解题方法解答本题:估算法,十字交叉法和列方程组求解法。
解法一:假设二者的物质的量之比以1∶1混合,则2.5mol丙烷燃烧放出的热已大于3847kJ,则A、C、D均不可能正确。
解法二:已知:
1 mol H2燃烧所放出的热量=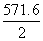 kJ·mol-1
kJ·mol-1
1 mol混合气体燃烧放出的热量=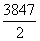 kJ·mol-1
kJ·mol-1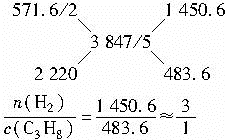
解法三:设混合气体H2、C3H8的物质的量分别为x、y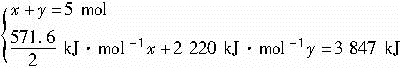
解之: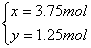
本题难度:一般
4、选择题 下列各组分子中,范德华力和氢键都存在的是?(?)
A.苯和CCl4
B.干冰
C.HI气体
D.甲醇和水
参考答案:
D
本题解析:
范德华力是一种普遍存在于固体、液体和气体分子之间的作用力。当氢原子与电负性大的原子以共价键结合时,氢原子能够跟另一种电负性大的原子之间形成氢键。D选项符合要求。
本题难度:一般
5、选择题 下列分子的中心原子的杂化类型与其他不同的是
A.SiCl4
B.H2S
C.PCl5
D.NH3
参考答案:C
本题解析:A.SiCl4的中心原子Si采用sp3杂化;B.H2S的中心原子S采用sp3杂化;C. PCl5的中心原子P采用sp3d杂化;D.NH3中的中心原子N采用sp3杂化。所以杂化方式不同的是PCl5。选项为C。
本题难度:简单