时间:2020-07-28 04:43:02
1、选择题 在强酸或强碱溶液中均能大量共存的离子组是
A.Ba2+、Cl-、NO3-、Na+
B.S2-、CO32-、K+、NH4+
C.Fe2+、NO3-、Cl-、HCO3-
D.Al3+、Cl-、AlO2-、Na+
参考答案:A
本题解析:分析:根据强酸或强碱溶液中离子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应,不能相互促进水解等,则离子能大量共存,以此来解答.
解答:A.强酸或强碱溶液中该组离子之间均不反应,能大量共存,故A正确;
B.S2-、CO32-分别与H+反应,OH-、NH4+结合生成弱电解质,则酸、碱溶液中均反应,不能共存,故B错误;
C.HCO3-既能与酸反应又能与碱反应,酸性溶液中Fe2+、NO3-发生氧化还原,碱溶液中Fe2+、OH-结合生成沉淀,则酸、碱溶液中均反应,不能共存,故C错误;
D.Al3+、AlO2-相互促进水解不能共存,且酸过碱溶液中均生成沉淀,则不能共存,故D错误;
故选A.
点评:本题考查离子的共存,注意习题中的信息及常见离子之间的反应即可解答,选项C为解答的难点,题目难度中等.
本题难度:简单
2、填空题 (10分)
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式 ;
已知:3Fe (s)+2O2(g)="=" Fe3O4(s) △H=-1118.4kJ? mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H= ,该反应达平衡时,化学平衡常数表达式K= 。
(2)某学生实验小组用50mL0.50mol?L—1的盐酸与50mL0.50mol?L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定
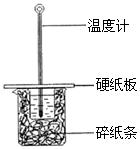
①图中装置缺少的一种仪器,该仪器名称为 。
②将反应混合液的 温度记为反应的终止温度。
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯K^S*5U.C#
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
参考答案:
本题解析:略
本题难度:简单
3、简答题 填空(用序号填写)
下列物质中①金刚石?②Ar?③N2?④SiO2?⑤H2SO4?⑥CaF2?⑦NaHCO3
(1)只存在共价键的化合物是______
(2)只存在离子键的是______
(3)既存在离子键又存在共价键的是______
(4)不存在化学键的是______
(5)N2溶于水破坏化学键吗?______.
参考答案:①金刚石属于非金属单质,只含有共价键;
②Ar属于非金属单质,无化学键;
③N2属于非金属单质,只含有共价键;
④SiO2属于共价化合物,只含有共价键;
⑤H2SO4属于共价化合物,只含有共价键;
⑥CaF2属于离子化合物,只含有离子键;
⑦NaHCO3属于离子化合物,既含有离子键,又含有共价键;
N2溶于水不破坏化学键;
故答案为:④⑤;⑥;⑦;②;不破坏化学键.
本题解析:
本题难度:一般
4、选择题 25℃时,KNO3在水中的饱和溶液物质的量浓度是6mol·L-1,若将1mol固体KNO3置于1L水中,则KNO3变成盐溶液过程的△H-T△S的取值为
A.<0
B.=0
C.>0
D.不能确定
参考答案:A
本题解析:因为1mol固体KNO3置于1L水中,没有达到饱和溶液,是自发进行的过程,所以△G=△H-T△S<0时才是自发过程。
考点:考察利用公式计算判断自发反应过程。
点评:正确理解焓判据和熵判据。
本题难度:一般
5、选择题 下列说法正确的是(?)
A.反应热就是反应中放出的能量
B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D.由C(石墨)→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
参考答案:C
本题解析:A.反应热,是等温下化学反应释放或吸收的热量。A错误;B.燃烧热是在25℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.单位为kJ·mol-1,在101 kPa时,1 mol碳燃烧生成CO2所放出的热量为碳的燃烧热,B错误;C.硫固体气化时要吸热,C正确;D.金刚石所具有的能量高,比石墨稳定性低,D错误。选C。
本题难度:一般