时间:2020-07-28 04:32:39
1、选择题 下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
参考答案:A
本题解析:s能级有一个原子轨道,p能级有3个院子轨道,d能级有5个原子轨道,f能级有7个原子轨道,所以A正确。能层数=能级数,所以第一能层只有s能级,第二能层有s、p能级,第三能层有s、p、d能级,以此类推,所以B、C错。2n2是各能层中可容纳的最多电子数,很多情况下电子达不到这个数。所以D错。正确答案选A。
点评:本题主要考查能层、能级的概念以及能层能级原子轨道之间的关系和容纳电子数。
本题难度:简单
2、填空题 已知某粒子的结构示意图为: 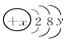
试回答:
(1)当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
(2)当y=8时,粒子可能为(填名称):
________、________、________、________、________。
(3)写出y=2的元素的碱与y=6的元素的最高价含氧酸发生反应的化学方程式________________________________________________________________________。
参考答案:(1)原子? (2)硫离子、氯离子、钾离子、钙离子、氩原子
(3)MgOH)2+H2SO4=MgSO4+2H2O
本题解析:(1)当x-y=10时,说明该微粒是不带电荷的,属于原子。
(2)当y=8时,说明核外电子数是18,则粒子可能为硫离子、氯离子、钾离子、钙离子、氩原子。
(3)y=2的元素的碱是氢氧化镁,y=6的元素的最高价含氧酸是硫酸,二者发生反应的化学方程式MgOH)2+H2SO4=MgSO4+2H2O。
点评:该题是中等难度的试题,也是高考中的常见题型。试题设计新颖,基础性强。旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确元素核外电子排布的规律,然后结合题意灵活运用即可。
本题难度:一般
3、选择题 下列关于非金属元素C、N、Si、S、Cl的叙述正确的是(?)
A.在通常情况下它们的单质均为气体
B.每一种元素都只能形成一种单质
C.它们的最高价氧化物的水化物都属于酸
D.它们的氢化物的水溶液都显酸性
参考答案:C
本题解析:略
本题难度:简单
4、选择题 据报道,月球上有大量3He存在,以下关于3He的说法正确的是?(?)
A.是4He的同素异形体
B.比4He少一个电子
C.是4He的同位素
D.比4He少一个质子
参考答案:C
本题解析:考查原子的组成及表示方法。在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因此3He和4He质子数相同,而中子数是不同的,所以互为同系物。答案选C。
本题难度:一般
5、选择题 短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
| ? | ? | R | ? | |
| T | Q | ? | W | G |
参考答案:B
本题解析:Q是无机非金属材料的主角,判定Q是硅元素,所以R、T、W、G分别是氮、铝、硫、氯元素。
A、W、G的离子的核外电子排布相同,核电荷数越多,半径越小,所以W>G,T的离子比W、G的离子少一个电子层,半径最小,错误;B、R的非金属性强于Q,所以最简单气态氢化物的热稳定性:Q < R,正确;C、Q、W、G的非金属性依次增强,所以最高价氧化物对应水化物的酸性依次增强,错误;D、T和G组成的化合物甲氯化铝属于强酸弱碱盐,溶于水后溶液呈酸性,错误,答案选B。
本题难度:简单