时间:2020-07-28 04:31:38
1、选择题 图是“康师傅”牌饮用矿泉水标签的部分内容(1mg=10-3g),从中可以推测( )
A.该矿泉水中Mg2+的物质的量浓度的最大值为2×10-4?mol?L-1
B.该矿泉水中Mg2+的物质的量浓度的最大值为1×10-4?mol?L-1
C.1瓶该纯净水中SO42-物质的量的最大值为2×10-4mol
D.1瓶该纯净水中SO42-物质的量的最大值为1×10-4mol
2、选择题 下列溶液中溶质的物质的量浓度为1 mol·L-1的是(? )
A.将40 g NaOH溶解于1 L水中配成的NaOH溶液
B.从1000 mL 1 mol/L NaCl溶液中 取出100 mL的溶液
取出100 mL的溶液
C.将1 L 10 mol/L的浓盐酸与9L水混合配成溶液
D.常温常压下将22.4 L HCl 气体溶于水配成1 L的盐酸溶液
3、简答题 如图是某种加钙食盐包装标签上的部分文字.请仔细阅读后回答以下问题: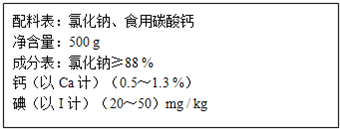
(1)包装标签上钙含量是指______(填“单质钙”、“碳酸钙”或“钙元素”);
(2)在家庭厨房中可选用食醋(CH3COOH)来检验此盐中是否含有碳酸钙,反应的化学方程式为______;
(3)为了测定此盐中钙的含量,取10g这种盐溶于足量盐酸,生成67.2mL(标准状况)二氧化碳.则此加钙食盐中钙元素的质量分数为______.(写出计算过程)
4、选择题 在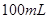
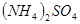 和
和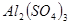 的混合溶液中,加入足量的
的混合溶液中,加入足量的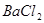 的溶液,生成
的溶液,生成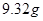 沉淀,再加入足量
沉淀,再加入足量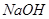 溶液并加热,生成
溶液并加热,生成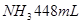 (标准状况),则原溶液中
(标准状况),则原溶液中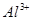 的浓度为
的浓度为
A.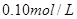
B.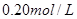
C.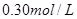
D.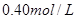
5、填空题 9.5gMgCl2固体溶于水配成500mL溶液,其浓度为?mol·L-1,从中取出100mL溶液,其中Cl-的浓度为?mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为?mol·L-1。