时间:2020-07-28 04:31:38
1、选择题 某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)=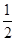 c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
A.KCl、Na2SO4
B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4
D.KCl、K2SO4、Na2SO4
参考答案:AC
本题解析:A、若KCl、Na2SO4的物质的量相同时,则电离生成的离子关系为 c(K+)=c(Cl-)=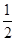 c(Na+)=c(SO42-),故A正确;B、若c(K+)=c(Cl-),则该溶液中溶质不可能有氯化钠,故B错误;C、若c(K+)=c(Cl-),则硫酸钾的物质的量是氯化钠的2倍。则只要在满足硫酸钠的物质的量等于硫酸钾即可满足c(K+)=c(Cl-)=
c(Na+)=c(SO42-),故A正确;B、若c(K+)=c(Cl-),则该溶液中溶质不可能有氯化钠,故B错误;C、若c(K+)=c(Cl-),则硫酸钾的物质的量是氯化钠的2倍。则只要在满足硫酸钠的物质的量等于硫酸钾即可满足c(K+)=c(Cl-)=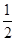 c(Na+)=c(SO42-)成立,故C正确;D、KCl、K2SO4、无论以何种比例混合,都c(K+)>c(Cl-),因此不会满足C c(K+)=c(Cl-)=
c(Na+)=c(SO42-)成立,故C正确;D、KCl、K2SO4、无论以何种比例混合,都c(K+)>c(Cl-),因此不会满足C c(K+)=c(Cl-)=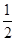 c(Na+)=c(SO42-),故D错误,答案选AC。
c(Na+)=c(SO42-),故D错误,答案选AC。
本题难度:一般
2、选择题 甲醛、乙酸和丙醛组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( )
A.54%
B.28%
C.27%
D.无法计算
参考答案:A
本题解析:
本题难度:一般
3、选择题 NA为阿伏加德罗常数,下列叙述错误的是(?)
A.46g NO2和N2O4的混合气体中含有的原子总数为3NA
B.12g金刚石中含有的共价键键数为4NA
C.0.1 mol NaHCO3晶体中含0.2NA个离子
D.将0.2 mol的硫化钾溶于水配成1升溶液,其阴离子数目肯定多于0.2NA
参考答案:B
本题解析:A中物质的最简式相同,正确。每个碳原子能形成4÷2=2个共价键,即12g金刚石中含有的共价键键数为2NA,所以B是错误的。C中阴离子和阳离子的个数之比是1︰1的,所以C正确。硫离子水解,因此选项D正确,答案选B。
本题难度:一般
4、选择题 8 g NaOH固体溶于水配成250 mL溶液,从中取出50 mL,则这50 mL NaOH溶液的物质的量浓度为( )
A.0.16 mol·L-1
B.4mol·L-1
C.0.8 mol·L-1
D.8 mol·L-1
参考答案:C
本题解析:8gNaOH物质的量为0.2mol,溶液体积为0.25L,所以溶液物质的量浓度为0.8mol/L。
点评:本题所配250mL溶液物质的量浓度为0.8mol/L,从中取出50mL,溶液物质的量浓度仍为0.8mol/L,因溶液具有均一性,溶液浓度与体积无关。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值。则下列说法正确的是
A.标准状况下,22.4L己烷中共价键数目为19NA
B.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
C.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3)
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
参考答案:C
本题解析:A.标准状况下,己烷不是气体,不能进行计算,A错误。B.Na2CO3溶液中CO32-
会发生水解,所以应小于NA个,B错误。D,D.常温下,铝与浓硫酸发生钝化,生成致密的氧化膜。D错误。故选C
本题难度:一般