时间:2020-07-28 04:30:57
1、选择题 在氮的氧化物中,氮元素和氧元素的质量比是7∶12,则氮元素的化合价是
A.+2
B.+3
C.+4
D.+5
参考答案:B
本题解析:根据质量比可以计算出N、O原子个数比为2∶3,则N元素的化合价为+3。
本题难度:困难
2、选择题 下列除去杂质的方法正确的是
①除去乙烷中的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液,干燥,蒸馏;
③除去苯中少量的苯酚:加足量的溴水,过滤;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
A.①②
B.②③
C.②④
D.③④
参考答案:C
本题解析:分析:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:①光照条件下通入Cl2,氯气会和乙烷之间发生取代反应,和乙烯之间发生加成反应,这样即将杂质除去,又将要留的物质反应了,不符合除杂的原则,故①错误;
②饱和碳酸钠溶液可以和乙酸之间发生中和反应,但是和乙酸乙酯是互不相溶的,分液即可实现分离,故②正确;
③溴易溶于苯,用溴水除杂会引入新的杂质,则除去苯中的少量苯酚,向混合物中加入NaOH溶液后分液,故③错误;
④乙酸与生石灰反应,而乙醇不能,且乙醇易挥发,而乙酸钙为离子型化合物,沸点高,故除去乙醇中少量的乙酸可以加足量生石灰后蒸馏,故④正确;
故选C.
点评:本题考查物质的除杂、混合物的分离提纯,明确物质的性质及常见混合物的分离方法是解答本题的关键,综合性较强,题目难度不大.
本题难度:困难
3、选择题 下列反应中,SO2作还原剂的是
A.SO2+NaOH=NaHSO3
B.2Mg+3SO2=S+2MgSO3
C.SO2+2H2S=3S+2H2O
D.2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
参考答案:D
本题解析:A.该反应中,各元素的化合价都不变,所以不是氧化还原反应,二氧化硫不是还原剂,故A错误;B.该反应中,二氧化硫中部分硫元素得电子化合价降低,所以部分二氧化硫作氧化剂,故B错误;C.该反应中,二氧化硫中硫元素得电子化合价降低,所以二氧化硫是氧化剂,故C错误;D.该反应中,二氧化硫中硫元素失电子化合价升高,所以二氧化硫是还原剂,故D正确;故选D.
考点:本题考查氧化还原反应,明确元素化合价是解本题关键,注意亚硫酸镁中硫显+4价,为易错点.
本题难度:一般
4、选择题 下列物质的水溶液中,加入Ba(OH)2溶液后原溶液中阴、阳离子都减少的是
A.Na2CO3
B.FeCl3
C.CuSO4
D.Ca(NO3)2
参考答案:C
本题解析:A中生成碳酸钡沉淀,阳离子没有减少;B中生成氢氧化铁沉淀,氯离子没有减少;D中不反应,都没有减少;C中生成硫酸钡和氢氧化铜,都减少,答案选C。
本题难度:困难
5、选择题 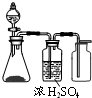 实验室利用下列各组物质制备并收集相应气体时,能采用下图实验装置的是
实验室利用下列各组物质制备并收集相应气体时,能采用下图实验装置的是
A.电石与水
B.浓硝酸与铜片
C.生石灰与浓氨水
D.过氧化氢溶液与MnO2
参考答案:BD
本题解析:分析:根据装置图可以看出,在不加热的条件下制备气体,在常温下进行,生成气体可用浓硫酸干燥,气体可用向上排空法收集,以此来解答题目.
解答:A.电石和水反应生成乙炔,具有还原性,不能用浓硫酸干燥,故A错误;
B.铜屑和浓硝酸在常温下可反应,生成二氧化氮气体可用浓硫酸干燥,密度比空气大,用向上排空法收集,故B正确;
C.生石灰与浓氨水生成氨气,氨气不能用浓硫酸干燥,故C错误;
D.过氧化氢溶液与MnO2生成氧气,密度比空气大,可用向上排空气法收集,故D正确;
故选BD.
点评:本题考查常见气体的制备、干燥和收集,做题时要充分考虑物质的性质,认真分析实验装置图的特点是解题的关键.
本题难度:困难