时间:2020-07-28 04:27:08
1、选择题 在一定温度下,反应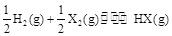 的平衡常数为10。若将
的平衡常数为10。若将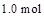 的
的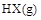 通人体积为1.0
通人体积为1.0 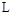 的密闭容器中,在该温度时的
的密闭容器中,在该温度时的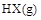 最大分解率接近于(?)
最大分解率接近于(?)
A.5%
B.17%
C.25%
D.33%
2、计算题 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/s 浓度mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol·L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
3、选择题 在高温下,反应2HBr(g)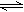 H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是(?)
H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是(?)
A.增大体积
B.增大压强
C.降低温度
D.保持体积不变增加氢气
4、填空题 (8分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则: (1)2min内,平均反应速率v(O2)=?; v(SO3)=?。
(1)2min内,平均反应速率v(O2)=?; v(SO3)=?。 (2)2min时,SO2的浓度为?
(2)2min时,SO2的浓度为? (3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
?
5、填空题 (8分)钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)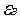 NaCl(l)+K(g)(正反应吸热)
NaCl(l)+K(g)(正反应吸热)
| 压强(kPa) | 13.33 | 53.32 | 101.3 |
| K的沸点(℃) | 590 | 710 | 770 |
| Ka的沸点(℃) | 700 | 830 | 890 |
| KCl的沸点(℃) | ? | ? | 1437 |
| NaCl的沸点(℃) | ? | ? | 1465 |
 ?。
?。