时间:2020-07-28 04:20:14
1、选择题 25 ℃时,在浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2SO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c(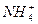 )分别为a、b、c(单位为mol·L-1),则下列判断正确的是(?)
)分别为a、b、c(单位为mol·L-1),则下列判断正确的是(?)
A.a="b=c"
B.c>a>b
C.b>a>c
D.a>c>b
参考答案:B
本题解析: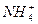 水解:
水解: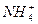 +H2O
+H2O NH3·H2O+H+,(NH4)2SO3溶液中
NH3·H2O+H+,(NH4)2SO3溶液中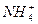 、
、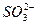 水解相互促进而增大了
水解相互促进而增大了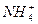 的水解,c(
的水解,c(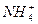 )浓度进一步减小;而(NH4)2Fe(SO4)2溶液中Fe2+水解:Fe2++2H2O
)浓度进一步减小;而(NH4)2Fe(SO4)2溶液中Fe2+水解:Fe2++2H2O Fe(OH)2+2H+,溶液呈酸性,对
Fe(OH)2+2H+,溶液呈酸性,对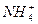 的水解有抑制作用,
的水解有抑制作用,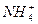 水解程度减小。
水解程度减小。
本题难度:简单
2、选择题 将0.1mol下列物质置于1L水中充分搅拌后,溶液中阳离子数最多的是(?)
A.KCl
B.Ag2S
C.AlCl3
D.CaCl2
参考答案:C
本题解析:此题涉及到物质溶解性、盐的水解等知识。依据“有弱才水解”规律,AlCl3能水解:Al3++3H2O Al(OH)3+3H+,由此可知,若有1mol Al3+水解,则能产生3mol H+,水解使阳离子数目增多。故C中阳离子数>0.1mol。A、D中nK+ =nCa2+=0.1mol(水电离出H+可忽略),B中的Ag2S在水中难溶,故溶液中阳离子数<0.1mol。
Al(OH)3+3H+,由此可知,若有1mol Al3+水解,则能产生3mol H+,水解使阳离子数目增多。故C中阳离子数>0.1mol。A、D中nK+ =nCa2+=0.1mol(水电离出H+可忽略),B中的Ag2S在水中难溶,故溶液中阳离子数<0.1mol。
错点警示:往往对盐的水解产生一种错误理解,即Al3+因水解而使Al3+浓度减小,本题已转移到溶液中阳离子总数多少的问题上。
本题难度:一般
3、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度 (mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
参考答案:(1)若a=7,则HA是强酸;若a>7,则HA是弱酸
(2)否? c(A-)=c(Na+)
(3)弱? c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-5? 10-5-10-9? 10-9
本题解析:(1)中,已知NaOH为一元强碱,而HA为一元酸,所以若a=7,则HA是强酸;若a>7,则HA是弱酸;(2)中,当HA是强酸时,则c为0.2,若HA是弱酸时,则c大于0.2,所以C不一定等于0.2,根据电荷守恒可知,c(A-)=c(Na+);(3)中,混合溶液的pH>7,这说明HA是弱酸,其浓度大小的排列为c(Na+)>c(A-)>c(OH-)>c(H+);(4)中,根据在常温下,Kw为10-14可知,当pH=9,即c(OH-)为10-9
所以c(H+)为10-5,根据c(H+)=c(OH-)= 10-5,所以丁组实验所得混合溶液中由水电离出的
c(OH-)=10-5 mol·L-1。根据电荷守恒可以知道,c(Na+)+ c(H+)=c(A-)+c(OH-),c(Na+)=0.005,
c(H+)=10-9,c(OH-)=10-5 mol·L-1,所以c(Na+)-c(A-)=(10-5-10-9)mol·L-1;c(Na+)= c(A-)+ c(HA)
即,c(A-)+ c(HA) + c(H+)=c(A-)+c(OH-),化简可得到c(HA) + c(H+)=c(OH-),
所以c(OH-)-c(HA)=c(H+)=10-9 mol·L-1。
点评:该题综合多个知识点,是高考的考查重点,该题的信息量较大,有一定的难度。
本题难度:困难
4、选择题 下列离子分别加入纯水中,能使水中c(OH-)增大的是()
A.Cl-
B.ClO-
C.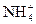
D.Na+
参考答案:B
本题解析:ClO-+H2O====HClO+OH-,水解呈碱性,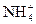 水解呈酸性。
水解呈酸性。
本题难度:简单
5、填空题 将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中c(A-)______c(HA);
(2)混合溶液中c(HA)+c(A-)______0.1 mol·L-1;
(3)混合溶液中由水电离出的c(OH-)__________0.2 mol·L-1HA溶液中由水电离出的
c(H+);
(4)25°C时,如果取0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
参考答案:(1)< (2)= (3)> (4)>
本题解析:(1)将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合时,溶质为等物质的量的HA和NaA,由于c(Na+)>c(A-),说明A-的水解能力大于HA的电离能力,使得c(HA)>c(A-)。
(2)通过物料守恒及等体积混合后浓度减半可知,c(HA)+c(A-)=0.1 mol·L-1。
(3)混合溶液中由于NaA的存在,促进水的电离,而0.2 mol·L-1HA溶液中水的电离受到抑制,因此前者由水电离产生的c(OH-)大于后者由水电离产生的c(H+)。
(4)如果取0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,溶质为等浓度的HA和NaA,混合溶液的pH<7,溶液呈酸性,说明HA的电离程度大于NaA的水解程度。
本题难度:一般