时间:2020-07-28 04:18:11
1、选择题 已知1.505×1023个X气体分子的质量为8克,则X气 体的摩尔质量为( )
体的摩尔质量为( )
A16克 B 32克 C 64gmol-1 D 32gmol-1
参考答案:D
本题解析:略
本题难度:一般
2、实验题 (6分)下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: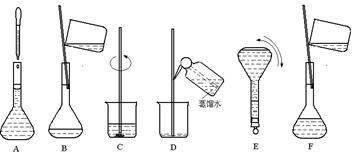
(1)用托盘天平称取Na2CO3·10H2O的质量是 。
(2)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是 。
(3)步骤B通常称为转移,步骤A通常称为 。
(4)将上述实验步骤A→F按实验过程先后次序排列 。
参考答案:(1) 2.9g (2)容量瓶 (3)定容 (4)CBDFAE
本题解析:配制 100 mL 0.100 mol·L-1 Na2CO3溶液配制 100 mL 0.100 mol·L-1 Na2CO3溶液需要Na2CO3·10H2O的物质的量为0.1L×0.100mol/L=0.010mol,则需要Na2CO3·10H2O的质量为0.01mol×286g/mol=2.86g,由于托盘天平只能称量到小数点后一位,所以需要Na2CO3·10H2O的质量为2.9g。步骤E为摇匀,需要的仪器是容量瓶。步骤A叫定容。配制溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀,装瓶贴签。所以A→F按实验过程先后次序排列为CBDFAE。
考点:一定物质的量浓度溶液的配置
点评:在计算所需溶质的质量时,要注意配制溶液的体积是否有相应的容量瓶,例如要配置480mL0.1mol/L的NaCl溶液,则计算时应该按500mL计算,因为没有480mL的容量瓶,只有500mL的容量瓶。
本题难度:一般
3、选择题 以下说法正确的是
A.1 mol O的质量为16 g
B.1 mol 氢的质量为1 g
C.1 mol C的质量为12 g/mol
D.1 mol氮的质量为 28 g/mol
参考答案:A
本题解析:略
本题难度:简单
4、选择题 0.5L 1mol/L FeCl3溶液中的Cl-的物质的量浓度为
A.3 mol/L
B.1.5 mol/L
C.1 mol/L
D.0.5 mol/L
参考答案:A
本题解析:浓度与溶液的体积大小无关,0.5L 1mol/L FeCl3溶液中的Cl-的物质的量浓度为3 mol/L,是FeCl3溶液浓度的3倍;
本题难度:一般
5、选择题 下列有关阿伏加德罗常数NA的说法中,不正确的是
A.标准状况下,分子数为NA的N2、C2H4混合气体的总质量为28 g
B.0.1 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数目为0.2 NA
C.60 g CaCO3与KHCO3的混合物与足量盐酸反应生成CO2分子数为0.6 NA
D.常温常压下,将0.1mol氯气通入水中发生化学反应,转移电子数为0.1 NA
参考答案:D
本题解析: A.氮气和乙烯的摩尔质量相同,故分子数为NA的气体物质的量为1mol,故质量为28g,故A正确;B. 0.1 mol Mg 反应镁化合价升高2价,转移电子数为0.2 NA,故B正确。C.60g固体的物质的量为0.6mol,与盐酸反应生成二氧化碳0.6mol,故C正确;D.0.1mol氯气通入水中,不能完全与水反应,故转移电子数不能计算,故D不正确。选D。
考点:阿伏伽德罗常数。
本题难度:一般