时间:2020-07-28 04:16:46
1、计算题 (9分)将0.1mol的镁铝混合物溶于100mL 2 mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。请回答: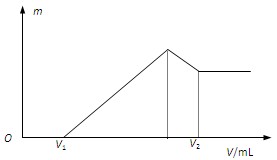
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=160mL时,则金属粉末中,n(Mg)=_______mol,V2=_______mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V (NaOH)=_______mL。
参考答案:(1)0.06? 440?(2)400
本题解析:(1)根据图像可知硫酸是过量的,当V1=160mL时,和金属反应的硫酸是0.2mol-0.16mol÷2=0.12mol,。设混合物中镁和铝的物质的量分别是x、y,则x+y=0.1mol、x+1.5y=0.12mol,解得y=0.04mol,x=0.06mol。所以和氯化镁、氯化铝反应消耗的氢氧化钠分别是0.12mol和0.12mol,而溶解氢氧化铝消耗的氢氧化钠是0.04mol,共计0.28mol,需要氢氧化钠溶液的体积是280ml,所以V2=160ml+280ml=440ml。
(2)根据(1)可知,要生成的沉淀最多,需要氢氧化钠溶液的体积是400ml。
本题难度:一般
2、选择题 在标况下,2.24L NOx气体的质量为3g则x值为(?)?
A.1
B.2
C.3
D.4
参考答案:A
本题解析:
正确答案:A
M(NOx)=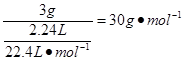 ,又14+16x=30,x=1
,又14+16x=30,x=1
本题难度:一般
3、填空题 (6分)某状况下,2g二氧化碳气体的体积是 1120 mL,2g A 气体的体积是 770 mL,A的摩尔质量是__________。 某金属氯化物 MCl2 40.5 g含 0.6 mol Cl-,则该氯化物的摩尔质量为__________,金属M的相对原子质量为__________。
参考答案:A的摩尔质量是__64g/mol________。
该氯化物的摩尔质量为_135g/mol_________,
金属M的相对原子质量为__64________。
本题解析:略
本题难度:简单
4、选择题 下列叙述中正确的是(?)
A.标准状况下,22.4 L H2SO4中含有6.02×1023个硫原子
B.常温常压下,O2和O3的混合物16g中含有6.02×1023个氧原子
C.500mL 0.5mol·L-1的Fe2(SO4)3溶液中SO42-浓度为0.75 mol·L-1
D.0.5mol OH-中含有3.01×1023个电子
参考答案:B
本题解析:略
本题难度:一般
5、填空题 (3分)与50ml 0.1mol/LNa2CO3溶液中Na+的物质的量浓度相同的是?(填代号)。
①25ml 0.2mol/L的NaCl溶液?②100ml 0.1mol/L的NaCl溶液
③25ml 0.2mol/L的Na2SO4溶液?④10ml 0.5mol/L Na2CO3溶液
参考答案:(3分)①
本题解析:略
本题难度:一般