时间:2020-07-28 04:11:54
1、选择题 下列为元素周期表的一部分,表中阿拉伯数字(1、2……)是原周期表中行或列的序号。请参照元素A~I在表中的位置,回答下列问题。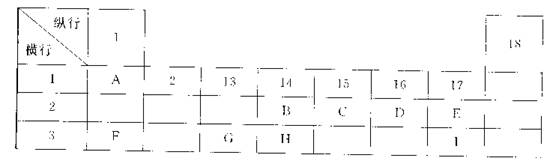
(1)B、C两元素中非金属性较强的是?(写出元素名称),请设计一个简单的实验证明这一结论?。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
?
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M。写出Z与Y反应的化学方程式:?。
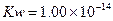 )
)参考答案:
(13分)
(1)(3分)氮(1分),取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3===NaNO3+H2O+CO2↑2HNO3+Na2CO3===2NaNO3+H2O+CO2↑(2分)(可不写化学方程式,其他合理的答案也得分)
(2)(2分)Al2O3+2OH-+3H2O===2[Al(OH)4]-(2分)
(3)(2分)2Na2O2+2H2O===4NaOH+O2↑(2分)
(4)(6分)第三周期,VIIA族(2分);
①2Cl-→Cl2↑+2e-(分)
②13(2分)
本题解析:略
本题难度:一般
2、选择题 下列粒子的结构示意图正确的是(? )
参考答案:C
本题解析:A项,K层最多只能容纳2个电子。B项,Cl-核电荷数为17。D项,最外层电子数不能超过8个。
本题难度:简单
3、选择题 下列各组物质中,互为同位素的是
A.O2和O3
B.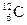 和
和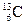
C.H2O和H2O2
D.CO和CO2
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列各项操作,其中错误的是
A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从漏斗颈下口流出,上层液体则从分液漏斗的上口倒出
C.萃取、分液前需对分液漏斗检漏
D.为保证分液漏斗内的液体顺利流出,需将分液漏斗上口部的塞子打开
参考答案:A
本题解析:
本题难度:一般
5、选择题 五种短周期金属元素在元素周期表中的相对位置如图所示,下列判断正确的是(? )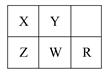
A.原子半径:Z<W<R
B.金属性:X>Z
C.氢氧化物的碱性:Z>W>R
D.最外层电子数:X>Y
参考答案:C
本题解析:该题考查元素位构性之间的关系。同一周期,从左至右,原子半径减小,得电子能力增强,氧化性增强,最高价氧化物对应的水化物碱性减弱,A错误,C正确;同一主族,从上到下,元素的金属性增强,B错误;最外层电子数:Y>X,D错误。
本题难度:一般