时间:2020-07-28 04:11:33
1、选择题 下列实验不能达到预期目的是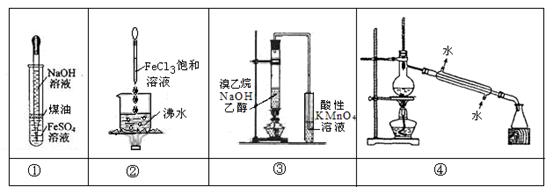
A.实验①:挤出胶头滴管中的NaOH溶液,观察Fe(OH)2沉淀的颜色
B.实验②:继续煮沸溶液至红褐色,停止加热,当光束通过体系时产生丁达尔效应
C.实验③:通过观察酸性KMnO4溶液紫色褪去,确认有乙烯生成
D.实验④:控制一定温度,将石油分离为汽油、柴油等
参考答案:C
本题解析:略
本题难度:一般
2、实验题 (16分,每空2分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: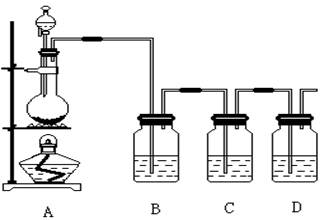
(1)装置A的分液漏斗中盛装的试剂是?,烧瓶中的化学反应方程式 ?。
(2)装置B所加试剂饱和NaCl溶液,其装置的作用是??。
(3)装置C中盛放的试剂是?(选填下列所给试剂的代码),实验现象为?,
该反应的离子方程式是??。
A.Na2S溶液? B.Na2SO3溶液? C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是?
A.全部? B.②③④⑥⑦? C.①②④⑤⑥? D.除 ①以外
(5)装置D中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式?。
参考答案:(16分)(1)浓盐酸?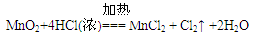
(2)??除去Cl2中的HCl气体
(3)A?; ?有淡黄色沉淀生成或者溶液变浑浊 ?;?S2-+Cl2=2Cl-+S↓ ?(4)B
(5)?Cl2+ 2OH_ ="==" Cl- + ClO- + H2O
本题解析:
(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2.故答案为:浓盐酸;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此B应是除去HCl气体的装置,除去Cl2中的HCl气体;
(3)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓。故答案为:A;有淡黄色沉淀生成;
(4)比较非金属性强弱的九条依据。元素在周期表中的相对位置;非金属单质与氢气化合的越容易,非金属性越强;气态氢化物的越稳定,非金属性越强;最高价氧化物对应的水化物的酸性越强,非金属性越强;非金属性强的元素的单质能置换出非金属性弱的元素的单质;非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱;与变价金属反应时,金属所呈价态越高,非金属性越强;几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱;能量:非金属元素原子得电子放热,放热越多离子越稳定,非金属越强。
我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强。
本题难度:一般
3、简答题 一天,小明走进实验室,看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题,展开了探究.
(1)小明提出下列猜想:
猜想一:如果试剂完全变质,则溶液中溶质是______;
猜想二:如果试剂部分变质,则溶液中溶质是NaOH和Na2CO3;
猜想三:如果试剂没有变质,则溶液中溶质是NaOH.
(2)写出NaOH发生变质的化学反应方程式:______.
(3)请你设计实验证实该试剂已经部分变质,完成探究方案:
| 实验步骤 | 预期现象及结论 |
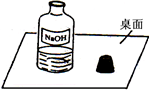
参考答案:(1)观察图,氢氧化钠溶液敞口放置时能与空气中二氧化碳直接接触,氢氧化钠溶液吸收二氧化碳生成碳酸钠和水而变质;全部变质,溶液中溶质为:Na2CO3(或碳酸钠);
故答案为:Na2CO3(或碳酸钠);
(2)图中盛放氢氧化钠溶液的试剂瓶敞口放置,氢氧化钠吸收空气中的二氧化碳生成碳酸钠而变质;
故答案为:CO2+2NaOH=Na2CO3+H2O;
(3)试剂部分变质需要检验溶液中含有碳酸钠和氢氧化钠; 取试剂少许加入足量氯化钡生成白色沉淀证明含有碳酸钠,静止后向上层溶液中滴加酚酞试液,溶液变红证明含有氢氧化钠;
故答案为:
实验操作实验现象及结论取少量待测液于试管,加入足量BaCl2溶液产生白色沉淀,则说明溶液中含有Na2CO3向静置后的上述试管中,滴加少量酚酞溶液溶液变红(1分),则说明溶液中含有NaOH
本题解析:
本题难度:一般
4、实验题 某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理并说明理由____________________
(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:3 mol·L-1 H2SO4、3%H2O2、6 mol·L-1 HNO3、0.01 mol·L-1KMnO4、NaOH稀溶液、0.1 mol·L-1
KI、20% KSCN、蒸馏水。
① 提出合理假设假设1:____________;假设2:____________;假设3:____________。
② 设计实验方案证明你的假设
(3)实验过程:根据②的实验方案,进行实验。请按下表格式写出实验操作步骤、预期现象与结论。 
参考答案:(1)该结论不正确。稀HNO3有强氧化性,若该铁的价态为+2价,则被氧化为+3价同样可使KSCN溶液变血红色。
(2)①假设假设1:催化剂中铁元素的价态全部为+3价;
假设2:催化剂中铁元素的价态全部为+2价;
假设3:催化剂中铁元素的价态为+3价、+2价。 (3)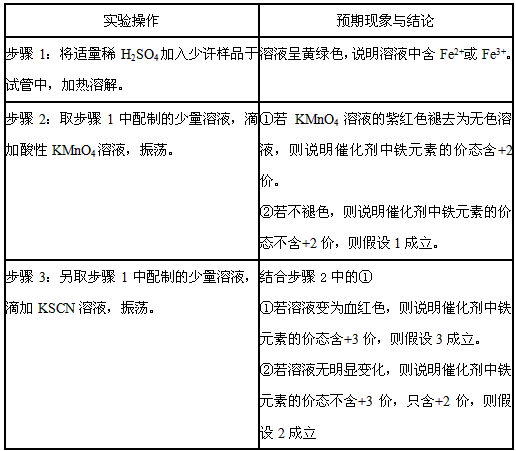
本题解析:
本题难度:一般
5、实验题 已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: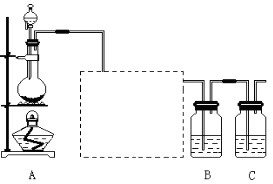
(1)装置A的分液漏斗中盛装的试剂是?,烧瓶中加入的试剂是?。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用?。
(3)装置B中盛放的试剂是?(选填下列所给试剂的代码),实验现象为?,反应的化学方程式为?。
A.Na2S溶液? B.Na2SO3溶液? C.Na2SO4溶液?
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)?。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为?。
参考答案:(1)浓盐酸?; MnO2;
(2) ?;除去Cl2中的HCl气体;
?;除去Cl2中的HCl气体;
(3)A ;有淡黄色沉淀生成 ; Na2S+Cl2 =2NaCl+ S↓ ;?
(4)HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等
(5)Cl2 + 2OH— =Cl— + ClO—+ H2O
本题解析:(1)装置A用于Cl2的制取,把MnO2放在烧瓶中,把浓HCl放在分液漏斗中。(2)加热A装置,发生反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。2的实验室制法、实验装置及试剂的选择、元素非金属性的比较、离子方程式的书写的知识。
MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。2的实验室制法、实验装置及试剂的选择、元素非金属性的比较、离子方程式的书写的知识。
本题难度:一般