时间:2020-07-28 04:10:31
1、选择题 一密闭容器中充人1mol N2和3mol H2,在一定条件下发生反应N2+3H2 2NH3,下列有关说法正确的是(?)
2NH3,下列有关说法正确的是(?)
A.达到化学平衡时,正反应和逆反应的速率都为零
B.当符合3u正(N2)=u正(H2)时,反应达到平衡状态
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项A不正确;选项B中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此B中的关系始终是成立,不正确;C中反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,正确;平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,D不正确,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点、特征,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
2、填空题 (10分) 在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)?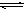 ?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度、体积不变,若起始时向容器中加入的物质的量如下列各项,反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
参考答案:(1)减少?(2)a=1? (3)正确?反应物没有完全转化,所以放出的热量少?
(4)ABC?(每空2分)
本题解析:(1)ΔH<0,说明是个放热反应,故升高温度,反应向左进行,故平衡常数减小,平衡常数为生成物的化学计量数次幂比上反应物的化学计量数次幂。
(2)升高温度,反应向左进行,混合气体的平均相对分子质量减小,说明生成物的化学计量数之和小于反应物的化学计量数之和,故a+1<3,a<2,故a为1。
(3)反应物没有完全转化,所以放出的热量少,故Q1一定小于Q。
(4)利用“一边倒”的方法计算X和Y的物质的量和开始加入的2 mol X和1 mol Y相比,若一样,则相等,此外,还要考虑,对于体积固定的密闭容器,加入惰性气体是没有影响反应方向。
点评:此题考核了对化学平衡常数的理解和掌握。
本题难度:困难
3、选择题 已知:CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡过程体系 | |||
| CO | H2O | CO2 | H2 | 能量的变化 | |
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
参考答案:C
本题解析:根据已知方程式可知,1molCO完全反应放出41kJ热量,而容器①放出32.8 kJ热量,所以转化率为32.8 kJ÷41kJ=0.8,所以A正确;根据反应方程式中气体系数相等的特点,容器②的CO2物料配比与容器①中CO相同,所以在相同条件下反应,两种情况下的转化率相等,因为正反应为放热反应,所以逆反应应为吸热,同样吸收32.8 kJ热量,B正确;由于2容器中含C物质的转化率相同,所以CO2的浓度不相等,C错误;方程式中 CO与H2O的反应系数相等,所以反应速率相等,达到平衡时也相等,所以当CO反应速率等于H2O的反应速率时反应也有可能达到平衡,所以D正确;故选C。
本题难度:一般
4、计算题 把4 mol N2和8 mol H2置于5 L密闭容器合成氨反应,经过2min后达到平衡时测得混合气体中含NH3的体积百分比为20%,求:(1)混合气体中含H2的体积百分比;?
(2)反应前后容器内的压强比;? (3)N2和H2的转化率。(4)求H2的反应速率
参考答案:(1)50%? (2)6:5? (3) N2的转化率为25%,H2的转化率为37.5%
本题解析:略
本题难度:简单
5、选择题 FeCl3溶液中滴加KSCN溶液变血红色,是因为发生了下列反应,FeCl3+3KSCN Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将(?)
Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将(?)
A.变浅
B.变深
C.不变
D.无法确定
参考答案:C
本题解析:反应的实质是Fe3++3SCN- Fe(SCN)3,可以看到K+、Cl-没有参加反应,加入少量KCl固体平衡不移动,故选C。
Fe(SCN)3,可以看到K+、Cl-没有参加反应,加入少量KCl固体平衡不移动,故选C。
点评:本题考查的是化学平衡的知识,学生需要注意的是抓住化学反应的本质,是解得本题的关键。
本题难度:简单