时间:2020-07-28 04:10:31
1、选择题 某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g)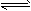 C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
[? ]
A.a=1
B.a=2
C.B的转化率为40%
D.B的转化率为20%
参考答案:AC
本题解析:
本题难度:一般
2、选择题 .可逆反应达到平衡的根本原因是(?)
A反应混合物中各组分的浓度相等? B.正逆反应都还在继续进行
C.正逆反应的速率均为零? D.正逆反应的速率相等
参考答案:D
本题解析:可逆反应达到平衡的根本原因是正逆反应的速率相等,且不为0,所以选项D正确,答案选D。
本题难度:简单
3、选择题 .在相同的容器中合成A(g)+2B(g) C(g)+2D(g),在恒温恒容条件下分别进行下列两种操作:
C(g)+2D(g),在恒温恒容条件下分别进行下列两种操作:
操作Ⅰ:起始加1mol A和n molB
操作Ⅱ:起始加1mol C和m molD
两种操作均到达平衡后B的体积分数相同,且A和B的转化率相同。下列有关的说法正确的是(?)
A.两种操作均到达平衡后,操作Ⅰ中的B的转化率与操作Ⅱ中C的转化率之和为100%
B.n=1
C.m=1
D.若A(g)+2B(g) C(g)+2D(g);⊿H>0,在t0时刻达到平衡,增大压强,其速率变化符合图示规律的图
C(g)+2D(g);⊿H>0,在t0时刻达到平衡,增大压强,其速率变化符合图示规律的图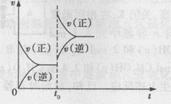
参考答案:A
本题解析:
两种操作均到达平衡后B的体积分数相同,且A和B的转化率相同,说明投料比符合计量系数比,且操作Ⅰ与操作Ⅱ完全等效。采用一边倒的转化和A与C的物质的量为1mol,可以确定n=2,m=2;图像的横轴是时间,纵轴是反应速率,t0时刻达到平衡,改变外界条件后,v(正)、v(逆)均增大,但是v(正)增大的幅度更大,所以,v(正)>v(逆),平衡正向移动。此反应的正反应为气体分子数相等的吸热反应,增大压强对其没有影响,升温正、逆反应速率均增大,平衡正向移动。若投料比符合计量系数比,两种操作均到达平衡后,操作Ⅰ中的反应物的转化率与操作Ⅱ中反应物的转化率之和为100%。
本题难度:简单
4、选择题 在某温度下,H2和I2各0.10mol的气态混合物充入10L的密闭容器中,发生反应:H2(g)+I2(g)  ?2HI(g),充分反应后达到平衡,测得c(H2)=0.008 mol?L-1,则该反应的平衡常数为(?)
?2HI(g),充分反应后达到平衡,测得c(H2)=0.008 mol?L-1,则该反应的平衡常数为(?)
A.40
B.62.5
C.0.25
D.4
参考答案:C
本题解析:平衡时,c(H2)=0.008mol?L-1,则:
H2(g)+I2(g)?2HI(g),
开始(mol/L):0.01? 0.01? 0
变化(mol/L):0.002? 0.002? 0.004
平衡(mol/L):0.008? 0.008? 0.004
故平衡常数k= c2(HI)/ c(I2)?c(H2)=0.0042/0.008×0.008=0.25。
本题难度:一般
5、填空题 在298K时,合成氨反应N2(g)+3H2(g)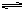 2NH3(g)△H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是?。
2NH3(g)△H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是?。
参考答案:该反应是可逆反应,1mol N2和3mol H2不能完全反应到底。
本题解析:由于该反应是可逆反应,结合可逆反应的特点:反应永远不能进行到底,得到测得放出的热量总是小于92.2kJ。
本题难度:简单