时间:2020-07-28 04:08:25
1、简答题 某研究性学习小组将实验室制备二氧化碳气体反应后的废物进行处理,目的是制取中性干燥剂CaCl2.得到固体后,他们对固体的成分进行了如下探究:
[提出猜想]
猜想一:只有CaCl2
猜想二:CaCl2和CaCO3
猜想三:CaCl2和HCl
通过讨论,大家认为“猜想三”不成立,理由是______.
[实验探究]
| 操作 | 现象 | 结论 步骤一 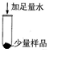 ______ | 猜想二成立 步骤二 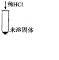 ______ |
参考答案:[提出猜想]得到固体后,他们对固体的成分进行了探究,做出的猜想中,“猜想三”不成立,理由是CaCl2是固体,氯化氢气体溶于水是盐酸,盐酸是液体,
故答案为:CaCl2是固体,盐酸是液体(CaCl2是固体、盐酸是液体、盐酸易挥发;合理即可);
[实验探究]探究对象是固体,而猜想三中的HCl是气体;根据碳酸钙不溶于水,样品溶于水,固体部分溶解,与稀盐酸反应有气泡冒出,可以判断碳酸钙是否存在,故答案为:
操作现象实验结论步骤一固体部分溶解步骤二固体溶解,产生气泡(1)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平后的反应为CaCO3+2HCl=CaCl2+CO2↑+H2O,故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)根据复分解反应发生的条件,总结出得到CaCl2的不同途径,即碱和盐反应生成新碱和新盐,因此Z可能是Cu(OH)2、Fe(OH)3、Mg(OH)2、Zn(OH)2、Al(OH)3、Fe(OH)2等难溶性碱;碱和酸或金属氧化物与酸反应生成盐和水,因此“YCln”属于酸,
故答案为:①Cu(OH)2[Fe(OH)3、Mg(OH)2、Zn(OH)2、Al(OH)3、Fe(OH)2等难溶性碱;②酸;
(3)①氯化钙和硝酸不反应,①不符合;
②AgNO3 氯化钙和硝酸银反应生成氯化银沉淀,故②符合;
③Na2CO3与 氯化钙反应生成碳酸钙沉淀,故③符合;
④Fe(OH)3 与氯化钙不反应,故④不符合;
⑤Mg不与氯化钙反应,故⑤不符合;
⑥BaCO3不与氯化钙反应,故⑥不符合;
故答案为:②③.
本题解析:
本题难度:一般
2、选择题 下列实验操作中错误的是(? )?
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上,置于天平左盘,砝码放在天平右盘中
参考答案:C
本题解析:蒸发时,如果出现大量的固体时,就应该停止加热,利用余热蒸干即可,选项C不正确,其余选项都是正确的,答案选C。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:简单
3、实验题 某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1,?催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol?L-1)的用量均为2mL。
(1)配平化学方程式:
______KMnO4 +____H2C2O4 +_____H2SO4 → ____K2SO4 +_____MnSO4 +_____CO2 +______H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/ g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和______探究催化剂对该反应速率的影响 |
| ② | ? | ? | ? | |
| ③ | ? | ? | ? | |
| ④ | ? | 0 | ? |
| KMnO4酸性溶液 的浓度?/?mol?L-1 | 溶液褪色所需时间?t / min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
参考答案:(11分)(1) 配平化学方程式:(2分,全对才给分)
2KMnO4 +5H2C2O4 +3H2SO4 → 1K2SO4 +2MnSO4 +10CO2 +8H2O
(1)?请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:(每一行1分,共3分)
实验编号
T/K
催化剂的用量/ g
KMnO4酸性溶液的浓度/mol?L-1
实验目的
①
298
0.5
0.01
(Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响;
(Ⅱ)实验①和③探究温度对该反应速率的影响;
(Ⅲ)实验①和④探究催化剂对该反应速率的影响
②
298
0.5
0.001
③
323
0.5
0.01
④
298
0
0.01
(3)生成的Mn2+催化反应的进行(1分),B(1分)
(4)1×10-4mol/L.min (1分)?
(5)不可行(1分)。取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的KMnO4溶液反应(2分)
本题解析:(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,根据电子的得失守恒可知,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
(2)要得出反应物浓度、温度、催化剂对反应速率影响的结论至少要完成:①取不同浓度KMnO4溶液,在相同温度下进行反应;②取同浓度KMnO4溶液,在不同温度下进行反应;③取同浓度KMnO4溶溶,在同温度且有催化剂的条件下进行反应;④取同浓度KMnO4溶液,在同温度且不使用催化剂的条件下进行反应等3个实验来进行对比。
(3)根据反应的方程式可知,生成物中有Mn2+生成,这说明引起反应速率加快的原因还可能是生成的Mn2+催化反应的进行,据此可知,如果要验证假设,则可以选择试剂硫酸锰,答案选B。
(4)①反应开始时:c(KMnO4)= ,反应时间:△t=(6min+7min+7min)÷3=6.7min,所以KMnO4的平均反应速率ν(KMnO4)=
,反应时间:△t=(6min+7min+7min)÷3=6.7min,所以KMnO4的平均反应速率ν(KMnO4)= 。
。
②由题中数据知浓度大的褪色时间反而长,因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较,故不经过计算直接利用表中的褪色时间长短来判断浓度大小与反应速率的关系是不可行的;所以若想通过直接观察褪色时间长短来判断溶液浓度的大小,则必须保证KMnO4酸性溶液的浓度相同,才能判断H2C2O4溶液浓度的大小,即取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。
点评:该题是高考中的常见题型,所以中等难度的试题。试题综合性强,侧重对学生能力的培养和胶体方法的指导与训练,有利于培养学生规范、严谨的实验设计、评价能力,有利于提高学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
4、实验题 某化学科外活动小组所做实验如图所示:图中→表示气流方向,M是纯净干燥的气体,Y是另一种气体,E内有红棕色气体产生,实验所用药品只能在下列物质中选用:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、NH4HCO3碱石灰、蒸馏水。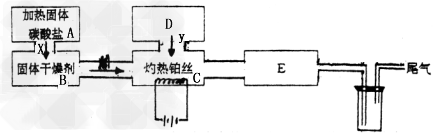
填写下列空白:
(1)A中所用装置的主要仪器有:___________________。
(2)B中选用的干燥剂是_________,其作用是_______________。
(3)C中发生的主要化学方程式为____________________ 。
(4)D中制取Y的化学方程式为____________________ 。
参考答案:(1)大试管,铁架台(带铁夹)、酒精灯
(2)碱石灰 ;吸收CO2和H2O,干燥NH3
(3)4NH3+5O2=4NO+6H2O?
(4)2Na2O2+2H2O=4NaOH+O2↑
本题解析:
本题难度:一般
5、选择题 选用实验装置完成对应的实验,能达到目的的是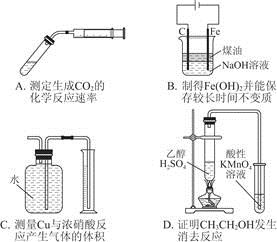
参考答案:A
本题解析:B项应铁作阳极,错误;C项NO2能与水反应,错误;D项没有排除SO2气体、乙醇蒸气的干扰,错误。
本题难度:简单