时间:2020-07-28 03:50:37
1、选择题 下列叙述不正确的是(?)
A.c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液和NH4Cl溶液中,溶质浓度大小关系是: c[(NH4)2SO4]< c[(NH4HSO4] < c(NH4Cl)
B.欲除去CuCl2溶液中混有少量的FeCl3,可加入CuO
C.0.2mol/L HCl溶液与等体积0.05mol/L Ba(OH)2溶液混合后,溶液的pH=1
D.0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
参考答案:C
本题解析:硫酸氢铵能够电离出氢离子,抑制NH4+的水解,所以A是正确的;氧化铜能够调节溶液的酸碱性,从而使铁离子形成沉淀,且不会引入新的杂质,B正确;C中盐酸是过量的,反应后氢离子难点是 ,因此pH不是1,C不正确;根据电荷守恒和物料守恒可知,D中的关系是正确的,答案选C。
,因此pH不是1,C不正确;根据电荷守恒和物料守恒可知,D中的关系是正确的,答案选C。
点评:该题的难点在选项D上,主要是由于不能熟练掌握电荷守恒、物料守恒以及质子守恒导致的,该题难度较大。
本题难度:一般
2、选择题 下列说法正确的是(?)
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(N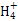 )>c(Cl-)
)>c(Cl-)
C.0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后溶液中离子浓度的大小关系是:c(Cl-)>c(N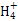 )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
D.0.1 mol·L-1硫化钠溶液中离子浓度的关系:c(Na+)=c(S2-)+c(HS-)+c(H2S)
参考答案:C
本题解析:CH3COONa溶液中由于CH3COO-水解显碱性,同时生成CH3COOH,A错;根据溶液电中性,c(N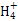 )+c(H+)=c(Cl-)+c(OH-),由溶液的pH=7,可知c(H+)=c(OH-),故c(N
)+c(H+)=c(Cl-)+c(OH-),由溶液的pH=7,可知c(H+)=c(OH-),故c(N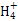 )=c(Cl-),B错;0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后得到浓度均为:0.025 mol·L-1的NH4Cl、NH3·H2O、NaCl混合溶液,其中NH3·H2O的电离程度大于NH4Cl的水解程度,故c(Cl-)>c(N
)=c(Cl-),B错;0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后得到浓度均为:0.025 mol·L-1的NH4Cl、NH3·H2O、NaCl混合溶液,其中NH3·H2O的电离程度大于NH4Cl的水解程度,故c(Cl-)>c(N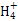 )>c(Na+)>c(OH-)>c(H+),C对;根据物料守恒,硫化钠溶液中存在:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],D错。
)>c(Na+)>c(OH-)>c(H+),C对;根据物料守恒,硫化钠溶液中存在:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],D错。
本题难度:一般
3、选择题 等体积的下列溶液,阴离子的总浓度最大的是?
A.0.2 mol/L K2S
B.0.1 mol/L Ba(OH)2
C.0.2 mol/L NaCl
D.0.2 mol/L(NH4)2SO4
参考答案:A
本题解析:题目要求找出阴离子总浓度最大的假设溶液均为1L,则从表面上看阴离子似乎都是0.2 mol/L,浓度相同,但仔细检查,原来K2S是弱酸强碱盐,根据“有弱就水解”可知,以上溶液的阴离子仅有S2-会水解,
即
S2-+H2O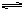 HS-?+OH-
HS-?+OH-
一个S2-离子水解可生成一个HS-离子和一个OH-离子,溶液中[S2-]+[HS-]+[OH-]大于0.2 mol/L,所以阴离子总浓度最大的是A。
本题难度:一般
4、填空题 (8分)化合物SOCl2是一种液态 化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消
化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消 失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
(1)根据上述实验,写出SOCL2和水反应的化学方程式? ?__.
?__.
(2)AlCl3溶液蒸干灼 烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是? __________________________?__________________.
烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是? __________________________?__________________.
参考答案:(1)SOCl2 + H2O =?SO2 + 2HCl
(2)若AlCl3溶液蒸干灼烧,AlCl3在水中存在如下平衡:AlCl3+3H2O 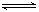 ?Al(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3
?Al(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3 ?Al2O3+3H2O↑,因此固体产物主要为Al2O3.SOCl2和水反应生成SO2和HCl ,一方面使水的物质的量减少,另一方面生成的酸抑制AlCl3的水解,所以SOCl2和AlCl3·6H2O共热可得AlCl3.
?Al2O3+3H2O↑,因此固体产物主要为Al2O3.SOCl2和水反应生成SO2和HCl ,一方面使水的物质的量减少,另一方面生成的酸抑制AlCl3的水解,所以SOCl2和AlCl3·6H2O共热可得AlCl3.
本题解析:略
本题难度:一般
5、选择题 关于NaHCO3溶液,下列表述不正确的是
A.c (Na+)= c (HCO3-)+ c (CO32-)+ c (H2CO3)
B.c(Na+)+ c (H+)=" c" (HCO3-)+ c (CO32-)+ c (OH-)
C.HCO3-的水解程度大于HCO3-的电离程度
D.c (H+) + c(H2CO3)=c (OH-)+ c(CO32-)
参考答案:B
本题解析:A、原子守恒,正确;B、电荷守恒,错误;C、正确;D、水电离平衡,正确。
本题难度:一般