时间:2020-07-28 03:46:43
1、选择题 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
[? ]
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O==2LiOH+H2↑
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列反应不可能是原电池反应的是
A.Fe + 2H+ = Fe2+ + H2↑
B.H+ + OH- = H2O
C.2H2 + O2 = 2H2O
D.Fe2+ + Zn =" Fe" + Cu2+
参考答案:B
本题解析:只有自发的、放热的氧化还原反应才能设计成原电池,酸碱中和反应是复分解反应,非氧化还原反应,不可能是原电池,选B。
考点:考查原电池的构成条件。
本题难度:一般
3、填空题 (10分)如图所示3套实验装置,分别回答下列问题。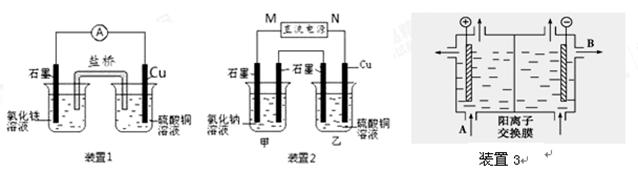
(1)装置1中的Cu是?极(填“正”或“负”),该装置发生的总反应的离子方程式为?。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为?极
② 乙烧杯中电解反应的离子方程式?。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
参考答案:(1)负? 2Fe3+ + Cu = 2Fe2+? + Cu2+
(2)?①正?
②2Cu2+ + 2H2O 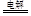 2Cu + O2 ↑ + 4H+
2Cu + O2 ↑ + 4H+
(3) ① A: 饱和NaCl溶液;? B :稀NaOH溶液
② 2Cl- + 2H2O 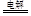 Cl2 ↑+ H2 ↑+ 2OH-
Cl2 ↑+ H2 ↑+ 2OH-
本题解析:⑴装置1为原电池,铜为负极,被氧化,石墨正极,其电池总反应为2Fe3++Cu═2Fe2++Cu2+;
⑵向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,说明甲中右边电极反应生成OH-,该极应为电解池的阴极,则M为电源的正极,N为电源的负极,由此可知甲为电解食盐水装置,而乙为电解硫酸铜溶液的装置,其阳极生成氧气,阴极生成铜,则电解的离子方程式为2Cu2++2H2O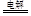 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
⑶根据电解池中阴离子移向阳极,阳离子移向阴极,图示装置中的交换膜是阳离子交换膜,A出口主要是饱和NaCl溶液,B出口主要是氢氧化钠溶液,甲装置是电解饱和食盐水,电解氯化钠溶液时生成氢氧化钠和氢气、氯气,其电解反应的离子方程式为:2Cl-+2H2O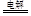 Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
本题难度:一般
4、选择题 下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下: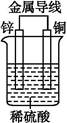

卡片上的描述合理的是( )
A.①②③
B.③④⑤
C.①⑤⑥
D.②③④
参考答案:B
本题解析:构成原电池的正极是Cu,负极是Zn,故①错误;电子从负极Zn流出,流向正极Cu,H+向正极移动,在Cu上得电子:2H++2e- H2↑,故②错误,③④正确;此原电池负极上发生的反应是Zn-2e-
H2↑,故②错误,③④正确;此原电池负极上发生的反应是Zn-2e- Zn2+,⑥错误;总反应方程式:Zn+2H+
Zn2+,⑥错误;总反应方程式:Zn+2H+ Zn2++H2↑,当有1 mol电子通过时,产生H2为0.5 mol,故⑤正确。
Zn2++H2↑,当有1 mol电子通过时,产生H2为0.5 mol,故⑤正确。
本题难度:一般
5、填空题 (13分)(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s) + O3(g) = 3Ag2O(s) ΔH1
已知2Ag2O(s) =" 4Ag(s)" + O2(g) ΔH2
则常温下反应: 2O3(g) = 3O2(g)的ΔH= (用ΔH1和ΔH2表示).
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应:
CH4(g) +2NO2(g)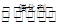 N2(g) +CO2(g) +2H2O(g)
N2(g) +CO2(g) +2H2O(g)
在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
参考答案:(1)2ΔH1+3ΔH2(2分)
(2)① (3分) ②减小 (2分) ③放热(2分)
(3分) ②减小 (2分) ③放热(2分)
④17.4% (2分)
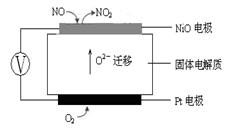
(3)NO+ O2--2e-= NO2 (2分)
本题解析:(1)①6Ag(s)+O3(g)
本题难度:困难