时间:2020-07-28 03:46:22
1、选择题 对H2O的电离平衡不产生影响的粒子是( )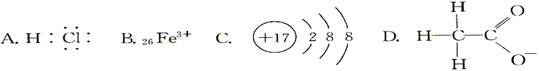
2、选择题 下列各碱溶液,当其pH相同时,物质的量浓度最大的是
A.KOH
B.NH3·H2O
C.Ba(OH)2
D.NaOH
3、选择题 水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
K(35℃)=2.1×10 -14。则下列叙述正确的是
[? ]
A.c(H+)随温度的升高而降低
B.在35℃时,c(H+)>c(OH-)
C.水的电离百分率a(25℃)>a(35℃)
D.水的电离是吸热的
4、实验题 (12分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是: ;
(4)如下图是某次滴定时的滴定管中的液面,其读数为 mL
(5)根据下列数据:请计算待测盐酸溶液的浓度: mol·L-1
| 滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
5、选择题 25℃时,相同物质的量浓度 ①KNO3 ②NaOH ③NH4Ac ④NH4Cl 溶液中,水的电离度由大到小排列顺序正确的是
A.①>②>③>④
B.④>③>①>②
C.③>④>②>①
D.③>④>①>②