时间:2020-07-28 03:35:35
1、选择题 下列说法不正确的是
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体
C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3)
参考答案:B
本题解析:A、加锌块与铁形成原电池,铁为正极受到保护,正确;B、蒸发时MgCl2水解生成氢氧化镁,错误;C、先生成亚硫酸钙,后被氧气氧化物硫酸钙及石膏,正确;D、(NH4)2SO4中含有2个NH,所以c(NH)相等时溶液浓度最低,NH4HCO3中NH4+水解受到HCO3-促进,水解程度大于NH4Cl,故其溶液浓度大于NH4Cl溶液,错误。
本题难度:一般
2、填空题 (1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了____。稀释后还需要加入一些铁粉,其目的是___。
(2)氯化铁水溶液呈____性,原因是____(用离子方程式表示)。
(3)根据盐水解原理用四氯化钛制备二氧化钛。试写出有关化学方程式____。
参考答案:(1)抑制Fe2+水解; 防止Fe2+被氧化
(2)酸; Fe3++3H2O 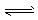 Fe(OH)3 +3 H+
Fe(OH)3 +3 H+
(3)TiCl4+2H2O=TiO2+4HCl
本题解析:
本题难度:一般
3、选择题 常温下,若HA溶液和NaOH溶液混合后pH=7,下列说法不合理的是
A.反应后HA溶液可能有剩余
B.生成物NaA的水溶液的pH可能小于7
C.HA溶液和NaOH溶液的体积可能不相等
D.HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等
参考答案:B
本题解析:HA溶液可能是强酸溶液,也可能是弱酸溶液;所以
A合理,若HA溶液为强酸溶液,当与NaOH溶液混合后pH=7,HA溶液不可能剩余,若HA溶液为弱酸溶液,当与NaOH溶液混合后pH=7,HA溶液有剩余;
B不合理,生成物NaA的水溶液的pH可能大于7也可能等于7,但一定不小于7;
C合理,溶液的体积多少与溶液的浓度有关;D合理,若HA溶液为弱酸,则HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等
本题难度:一般
4、填空题 物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
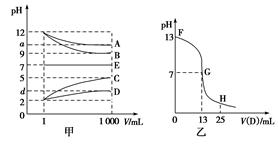
参考答案:(1)NaOH HCl
(2)NH3·H2O+H+=NH4++H2O
(3)①0.1 ②FG
③c(Na+)>c(OH-)≥c(CH3COO-)>c(H+)或c(Na+)>c(CH3COO-)≥c(OH-)>c(H+)
(4)12
本题解析:根据各物质的溶液从1 mL稀释到1 000 mL,pH的变化图象知,B和C溶液的pH变化为3,A和D溶液的pH变化小于3,则B为强碱,A为弱碱或强碱弱酸盐,C为强酸,D为弱酸或强酸弱碱盐,可先确定B为NaOH,C为HCl。结合A与D反应得到E,而E的pH不变,则E可能是NaCl或醋酸铵,结合B为NaOH,C为HCl,则推出E只能为醋酸铵,所以A为NH3·H2O,B为NaOH,C为HCl,D为CH3COOH。向NaOH溶液中滴加醋酸,起点pH=13,NaOH的浓度为0.1 mol·L-1。二者恰好完全反应生成醋酸钠,此时溶液显碱性,应该在FG区间。FG区间溶液呈碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),c(CH3COO-)和c(OH-)的大小关系无法判断。根据t ℃时,稀氨水中c(H+)和c(OH-)的值可知该温度下水的离子积常数KW为10-13,所以将100 mL 0.2 mol·L-1的HCl溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后,溶液呈碱性,c(OH-)=(100×0.4-100×0.2)/200(mol·L-1)=0.1 mol·L-1,c(H+)=KW/c(OH-)=10-12 mol·L-1,即pH=12。
本题难度:一般
5、选择题 下列有关说法正确的是? (? )
A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的ΔH>0
B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应
C.为保护海轮的船壳,常在船壳上镶入锌块
D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动
参考答案:C
本题解析:A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,根据ΔG=ΔH-TΔS<0,说明该反应的ΔH<0;B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是吸热反应,不是放热反应; C.为保护海轮的船壳,常在船壳上镶入锌块,锌块与船壳构成原电池的两极,锌块为阳极,保护阴极船壳; D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+是阳离子,向阴极移动。
本题难度:简单