时间:2020-07-28 03:35:35
1、选择题 0.1 mol/L K2CO3溶液中,若要使c(CO32-)更接近0.1 mol/L,可采取的措施是
A.加入少量盐酸
B.加KOH固体
C.加水
D.加热
参考答案:B
本题解析:如果要使c(CO32-)更接近于0.1mol/L,抑制碳酸根离子水解的条件即可。A、加入盐酸会和碳酸根反应生成水和二氧化碳,碳酸根离子浓度减小,故A错误;B、加入水稀释会导致溶液中离子浓度减小,故B错误;C、解热会刺激碳酸根离子水解,导致离子浓度减小,故C错误;D、加入氢氧化钾固体,会抑制碳酸根水解,使得碳酸根浓度接近0.1mol/L,故D正确.故选D.
本题难度:一般
2、选择题 下列根据反应原理设计的应用,不正确的是
A.CO32-+H2O HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3(胶体)+3H+ 明矾净水
Al(OH)3(胶体)+3H+ 明矾净水
C.Al3++3HCO3-=Al(OH)3↓+3CO2↑ 泡沫灭火器灭火
D.SnCl2+H2O=Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
参考答案:D
本题解析:A、水解是吸热的,加热促进水解,所以根据水解方程式CO32-+H2O HCO3-+OH-可知,热的纯碱溶液更有利于清洗油污,A正确;B、明矾溶于水电离出的Al3+水解生成氢氧化铁胶体,胶体具有吸附性可以使水中的悬浮物沉淀下来,因此明矾可以作为净水剂,B正确;C、Al3+与HCO3-水解相互促进生成氢氧化铝和CO2,所以泡沫灭火器可用来灭火,C正确;D、Sn2+水解溶液显酸性,因此配制氯化亚锡溶液时应加入盐酸以及抑制Sn2+水解,加入氢氧化钠促进Sn2+水解,D不正确,答案选D。
HCO3-+OH-可知,热的纯碱溶液更有利于清洗油污,A正确;B、明矾溶于水电离出的Al3+水解生成氢氧化铁胶体,胶体具有吸附性可以使水中的悬浮物沉淀下来,因此明矾可以作为净水剂,B正确;C、Al3+与HCO3-水解相互促进生成氢氧化铝和CO2,所以泡沫灭火器可用来灭火,C正确;D、Sn2+水解溶液显酸性,因此配制氯化亚锡溶液时应加入盐酸以及抑制Sn2+水解,加入氢氧化钠促进Sn2+水解,D不正确,答案选D。
本题难度:一般
3、填空题 (6分)常温下,已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合后,所得溶液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
(1)高碘酸是?(填“强酸”或“弱酸”)
(2)0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合后所得溶液中,
c(IO3-)?c(Na+)(填“大于”、“小于”或“等于”)。
(3)已知某溶液中只存在OH-、H+、IO4-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
A.c(Na+)>c(IO4-)>c(OH-)>c(H+)
B.c(IO4-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(OH-)>c(IO4-)>c(H+)
D.c(IO4-)>c(Na+)>c(H+)>c(OH-)
填写下列空白:
①若溶液中只有一种溶质,则该溶质是?,上述四种离子浓度大小顺序为?________(填选项的标号)
②若上述关系中C项是正确的,则溶液中的溶质有?、?
参考答案: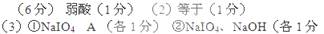
本题解析:略
本题难度:一般
4、选择题 在Na2S溶液中下列关系不正确的是
A.c(Na+) =2c(HS-) +2c(S2-) +c(H2S)
B.c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)>c(S2-)>c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+c(H2S)
参考答案:A D
本题解析:电荷守恒:c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-);
物料守恒:c(Na+) =2c(HS-) +2c(S2-) +2c(H2S);
质子守恒:c(OH-)=c(HS-)+c(H+)+2c(H2S),选A D
本题难度:一般
5、选择题 在NH4Cl饱和溶液中分别加入①Mg;②NH4Cl(固);③NH4HCO3;④H2O;⑤氯水;⑥
Cu。能使该溶液的pH值增大的是(?)
A.②③
B.①②⑤
C.②③⑥
D.①③④
参考答案:D
本题解析:在NH4Cl饱和溶液中由于NH4+水解使该溶液呈酸性,要使溶液的pH值增大,则可采取减少溶液中的[H+]。①Mg、③NH4HCO3与溶液中H+反应,而④H2O虽促进NH4+水解,但溶液中[H+]却是减少的。
本题难度:一般