时间:2020-07-28 03:35:35
1、选择题 下列电解质溶液的有关叙述正确的是(? )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.95℃纯水的pH<7,说明加热可导致水呈酸性
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)= c(HCO3-)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)= c(CH3COO-)
参考答案:D
本题解析:A不正确,因为不能确定溶液中氢离子和OH-的浓度;加热促进水的电离,pH减小,但水仍然是中性的,B不正确;C中恰好生成碳酸氢钾,但由于HCO3-的水解程度大于电离吃得好,溶液显碱性,所以c(K+)> c(HCO3-),C不正确;D中溶液可能显酸性,则根据电荷守恒定律可知,c(Na+)= c(CH3COO-),D正确,答案选D。
点评:该题是中等难度的试题,试题基础性强,难易适中,侧重对学生能力的培养和方法的指导与训练。该题的关键是利用好电荷守恒、物料守恒等,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
2、选择题 下列变化不属于盐类水解反应的是(?)
①NH3+H2O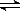 NH4++OH-?②HCO3- + H2O
NH4++OH-?②HCO3- + H2O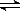 H2CO3+OH-
H2CO3+OH-
③HCO3-+H2O 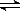 H3O++CO32-?④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
H3O++CO32-?④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
⑤A1O2-+HCO3-+H2O=Al(OH)3↓+CO32-?⑥NH4++2H2O 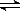 NH3·H2O+H3O+
NH3·H2O+H3O+
A.①③⑤
B.②③⑤
C.①④⑤
D.①③
参考答案:A
本题解析:①是化学平衡,③是电离平衡,⑤是复分解反应。所以正确的答案是A。
本题难度:简单
3、选择题
A.所得混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.混合后溶液pH=7
C.所得混合液中存在c(CH3COOH)+ c(CH3COO-)=0.05mol/L
D.混合后溶液中存在c(CH3COOH)+c(CH3COO-)=c(Na+)+ c(H+)
参考答案:C
本题解析:醋酸与氢氧化钠恰好反应,得到醋酸钠溶液,由于少量醋酸根离子的水解,使Na+浓度略小于CH3COO-浓度,OH-浓度大于H+浓度,A、B错;利用Na元素守恒,可以计算出醋酸钠的浓度为0.05 mol/L,根据元素守恒,也可以判断,醋酸与醋酸根离子浓度之和也是0.05 mol/L,C对;醋酸根离子水解生成的醋酸分子与OH-离子物质的量相同,但溶液中还有来源于水电离出的氢氧根离子,根据电荷守恒可以判断,D错误。
本题难度:简单
4、选择题 下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是(?)
A.FeCl2、Fe2(SO4)3
B.FeCl2、FeCl3
C.NaHCO3、Na2CO3
D.Mg(HCO3)2、MgCl2
参考答案:A
本题解析:略
本题难度:一般
5、选择题 下列各步制取物质,最终无法达到目的的有( )
A.Al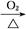 Al2O3
Al2O3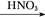 Al(NO3)3
Al(NO3)3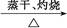 Al2O3
Al2O3
B.Cu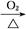 CuO
CuO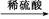 CuSO4溶液
CuSO4溶液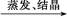 CuSO4·5H2O
CuSO4·5H2O
C.Fe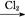 FeCl3
FeCl3 Fe(OH)3
Fe(OH)3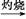 Fe2O3
Fe2O3
D.FeSO4溶液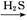 FeS
FeS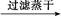 FeS
FeS
参考答案:D
本题解析:由于HNO3挥发,Al3+水解平衡右移,最后蒸干灼烧可得到Al2O3,所以A项正确;同理B、C两项正确。由于FeSO4与H2S不反应,故D项实验设计原理不正确,从而得不到FeS,所以D项错。
本题难度:一般