时间:2020-07-28 03:35:15
1、选择题 已知热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b,下列说法正确的是[ ]
A.该反应的ΔH2=+483.6kJ/mol
B.|ΔH2|<|ΔH1|
C.|ΔH2|>|ΔH1|
D.热化学方程式中化学计量数表示分子个数
2、填空题 Ⅰ.氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol 请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量。写出该反应的热化学方程式 。
3、选择题 在指定溶液中,下列各组离子一定能大量共存的是
A.pH=1的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=13的溶液:Na+、K+、AlO2-、CO32-
4、选择题 下列热化学方程式书写正确的是( )
A.2SO2+O2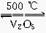 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+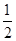 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ·mol-1
D.C(s)+O2(g)===CO2(g)ΔH=393.5 kJ·mol-1
5、填空题 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1
CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g) ΔH3
6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3= kJ·mol-1。
(2)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1="-197" kJ·mol-1;
2SO3(g) ΔH1="-197" kJ·mol-1;
H2O(g) H2O(l) ΔH2="-44" kJ·mol-1;
H2O(l) ΔH2="-44" kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) 2H2SO4(l) ΔH3="-545" kJ·mol-1。
2H2SO4(l) ΔH3="-545" kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是 。
(3)大气中的部分碘源于O3对海水中I-的氧化。O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g) IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为 ,其反应热ΔH= 。