时间:2020-07-08 01:56:44
1、选择题 下列关于杂化轨道的叙述中,正确的是
[? ]
A.分子中的中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构
B.CCl4分子中有四个完全等同的sp3-pσ键
C.杂化轨道一般只用于形成σ键或用于容纳未参与成键的孤对电子
D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
参考答案:BC
本题解析:
本题难度:一般
2、填空题 水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为_____________。
(2)已知2H2O?=?H3O+?+?OH-,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为_________。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低,并说明理由。稳定性_____________理由______________。沸点________________理由:______________。
参考答案:(1)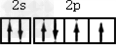 ?
?
(2)三角锥形;sp3?
(3)δs-p?
(4)稳定性:H2O>H2S>H2Se;因为非金属性越强,气态化合物越稳定;沸点:H2O>H2Se>H2S;H2O可形成分子间氢键,沸点最高,H2Se相对分子质量比H2S大,分子间作用力大,因而H2Se比H2S沸点高。
本题解析:
本题难度:一般
3、填空题 (三选一)【化学--选修物质结构与性质】
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)O、Si、N元素的电负性由大到小的顺序是_______。C60和金刚石都是碳的同素异形体,二者比较熔点高的是_______,原因是______________。
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为_______,每个COCl2分子内含有_____个δ键,______个π键。其中心原子采取_____杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是___________。
(3)CaTiO3晶体中(晶胞结构如图所示)? 晶体中,Z4+的氧配位数为________;晶体中,若将Ti4+置于立方体的体心,Ca2+置于立方体的顶点,则O2-处于立方体的______; 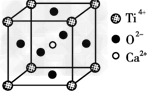
参考答案:(1)N>O>Si;金刚石;C60是分子晶体而金刚石是原子晶体
(2)①结构式“略”;3;1;sp2;②金属键
(3)12;所有棱心
本题解析:
本题难度:一般
4、选择题 下列关于丙烯(CH3-CH=CH2)的说法正确的( )
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子不存在非极性键
D.丙烯分子中3个碳原子在同一直线
参考答案:A
本题解析:
本题难度:简单
5、填空题 乙炔是有机合成工业的一种原料。工业上曾用CaC2 与水反应生成乙炔。
(1)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____。
(2)Ca2+的原子结构示意图:________;已知CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为____;1 mol O22+中含有的π键数目为____。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是____;分子中处于同一直线上的原子数目最多为________。
参考答案:(1)1s22s22p63s23p63d10
(2) ;
;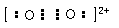 ? ;2NA
? ;2NA
(3)sp杂化、sp2杂化? ;3
本题解析:
本题难度:一般