时间:2020-07-08 01:56:44
1、选择题 下列关于杂化轨道的叙述中,正确的是
[? ]
A.分子中的中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构
B.CCl4分子中有四个完全等同的sp3-pσ键
C.杂化轨道一般只用于形成σ键或用于容纳未参与成键的孤对电子
D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
参考答案:BC
本题解析:
本题难度:一般
2、选择题 下列说法中正确的是( )
A.二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′
B.CH2O和ClO4-的中心原子上都含有孤对电子
C.BCl3、PCl5、H2O分子中均有一个原子的最外层电子不满足了8e-稳定结构
D.由原子间通过共价键形成的晶体一定比其他类别晶体熔、沸点高
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列选项中所发生的现象与电子的跃迁无关的是( )
A.平面镜成像
B.霓虹灯广告
C.燃烧蜡烛
D.燃放烟火
参考答案:A
本题解析:
本题难度:简单
4、填空题 能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。 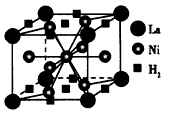
①Ni原子的价电子排布式是________________。
②该合金储氢后,含1 mol La的合金可吸附H2的数目为___________。
(2)南师大结构化学实验室合成了一种多功能材料-对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是__________________。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是_______________。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是__________,其中心原子N的杂化方式是___________。
参考答案:(1)①3d84s2;②3NA
(2)①O>N>C>H;②氢键 (3)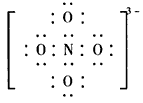 ;sp3
;sp3
本题解析:
本题难度:一般
5、填空题 雷尼镍( Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍一铝合金为原料制得。
(1)元素第一电离能:Al________Mg(填“>”、“<”或“=”)。
(2)雷尼镍催化的一实例为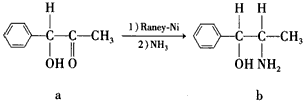
化合物b中采取sp3杂化的原子有:___________
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是__________(选填序号)。 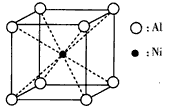
a.氯化钠 b.氯化铯 c.石英 d.金刚石
(4)实验室检验Ni2+可用丁二酮肟与之作用生成猩红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为__________
②在配合物中用配位键和氢键标出未画出的作用力(镍的配位数为4)。
参考答案:(1)<
(2)C N O
(3)b
(4)①1s22s22p63s23p63d8或[Ar]3d8②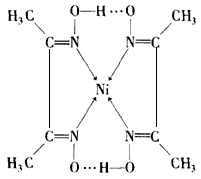
本题解析:
本题难度:一般