时间:2020-07-08 01:49:11
1、选择题 标准状况下,将V L A气体(摩尔质量为Mg·mol-1)溶于0.1 L水中,所得溶液密度为ρ g·mL-1。则此溶液物质的量浓度为
A. mol·L-1
mol·L-1
B. mol·L-1
mol·L-1
C. mol·L-1
mol·L-1
D. mol·L-1
mol·L-1
参考答案:B
本题解析:c= ,n=
,n= mol,
mol,
溶液质量=( ·M+100) g,所以溶液体积=
·M+100) g,所以溶液体积= ×10-3 L,
×10-3 L,
所以c= mol÷(
mol÷( ×10-3) L=
×10-3) L= mol·L-1。
mol·L-1。
本题难度:一般
2、选择题 用NA表示阿伏伽德罗常数的数值,下列叙述中错误的是(?)
A.标准状况下,22.4LCH4中含有4 NA个共价键
B.在熔融状态下,1molNaHSO4完全电离出的离子总数为3NA
C.5.5g超重水(T2O)中含有的中子数为3 NA
D.7.8gNa2O2与过量CO2反应,转移电子数为0.1NA
参考答案:B
本题解析:标准状况下,22.4L甲烷的物质的量是1mol,含有4mol共价键,A正确;在熔融状态下,硫酸氢钠的电离方程式是NaHSO4=Na++HSO4-,1molNaHSO4完全电离出的离子总数为2NA,B不正确;超重水含有12个中子,则5.5g超重水(T2O)中含有的中子的物质的量是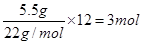 ,C正确;过氧化钠于CO2的反应中既是氧化剂,也是还原剂,转移1个电子,则7.8gNa2O2与过量CO2反应,转移电子数为0.1NA,D正确,答案选B。
,C正确;过氧化钠于CO2的反应中既是氧化剂,也是还原剂,转移1个电子,则7.8gNa2O2与过量CO2反应,转移电子数为0.1NA,D正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
3、选择题 下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:B
本题解析:A、质量的单位为g;C、摩尔质量单位为g/mol;D、1mol,标况下,22.4L的前提是气体。
本题难度:简单
4、选择题 下列说法正确的是
[? ]
A.1?mol氢约含有6.02×1023个微粒
B.1?mol?H2O中含有的氢原子数为2NA
C.钠的摩尔质量等于它的相对原子质量
D.1?mol硫酸的质量等于98?g/mol
参考答案:B
本题解析:
本题难度:简单
5、简答题 某进行无土栽培试验的实验室需要配制两份成分完全相同的某营养液,其配方如下表.
| KCl | K2SO4 | ZnSO4 0.3mol 0.2mol 0.1mol |
参考答案:原配方营养液中:n(K+)=n(KCl)+2n(K2SO4)=0.3mol+2×0.2mol=0.7mol,
n(SO42-)=n(K2SO4)+n(ZnSO4)=0.2mol+0.1mol=0.3mol,
n(Zn2+)=n(ZnSO4)=0.1mol,
n(Cl-)=n(KCl)=0.3mol,
调整配方后,选用氯化锌代替硫酸锌,营养液中相应离子物质的量相等,则:
根据锌离子相等n(ZnCl2)=n(Zn2+)=0.1mol,
根据氯离子相等n(KCl)=n(Cl-)-2n(ZnCl2)=0.3mol-2×0.1mol=0.1mol,
根据硫酸根离子相等n(K2SO4)=n(SO42-)=0.3mol,
溶液中n(K+)=n(KCl)+2n(K2SO4)=0.1mol+2×0.7mol=0.7mol,
故调整配方如下:选用氯化锌代替硫酸锌,并且各成份的用量分别为:氯化钾:0.1mol;硫酸钾:0.3mol;氯化锌:0.1mol,
答:用氯化锌代替硫酸锌,并且各成份的用量分别为:氯化钾:0.1mol;硫酸钾:0.3mol;氯化锌:0.1mol.
本题解析:
本题难度:一般