时间:2020-07-08 01:49:11
1、选择题 将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物的质量可能是
A.2g
B.4g
C.7.8g
D.10g
参考答案:BC
本题解析:略
本题难度:一般
2、计算题 取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出。试计算原混合液中Na2CO3和Na2SO4的物质的量浓度以及产生的气体在标准状况下的体积。
参考答案:c(Na2SO4)=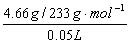 =0.40mol/L;
=0.40mol/L;
c(Na2CO3)=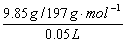 =1.0mol/L。在标准状况下生成1.12L CO2
=1.0mol/L。在标准状况下生成1.12L CO2
本题解析:题中反应关系:BaCl2+Na2CO3=BaCO3↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,知剩余白色固体为BaSO4。
14.51g白色沉淀为BaSO4和BaCO3的混合物,其中不溶于稀硝酸的是4.66g BaSO4,则BaCO3质量为:
14.51g-4.66g=9.85g。
c(Na2SO4)=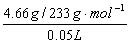 =0.40mol/L;
=0.40mol/L;
c(Na2CO3)=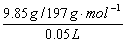 =1.0mol/L。
=1.0mol/L。
设生成标准状况下的CO2气体体积为xL。
BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
1mol 22.4L
9.85/197mol xL
x=1.12,即在标准状况下生成1.12L CO2
本题难度:简单
3、选择题 已知3.0g AO32-中核外电子数比质子数多6.02×1022个,下列说法中正确的是?
A.A原子的摩尔质量32g/mol
B.AO32-的摩尔质量为60
C.3.0gAO32-的物质的量是0.02mol
D.A元素的相对原子质量为12
参考答案:D
本题解析:AO32- 中核外电子数比质子数多2个,6.02×1022个质子的物质的量是0.1mol,所以3.0g微粒的物质的量是0.05mol,则摩尔质量是3.0g÷0.05mo=60g/mol,因此A原子的相对原子质量是60-16×3=12,答案选D。
本题难度:一般
4、计算题 (8分)200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充?分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比。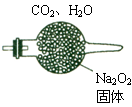
参考答案:CO2和H2O的物质的量比1:4
本题解析:考查应该过氧化钠反应的有关计算。
设原混合物中CO2和H2O的物质的量分别为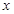 mol、
mol、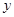 mol
mol
2Na2O2+2CO2=2Na2CO3+O2?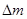
2mol? 56g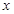 mol? 28
mol? 28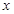 g
g
2Na2O2+2H2O=4NaOH+O2↑?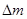
2mol? 4g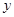 mol? 2
mol? 2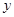 g
g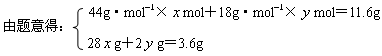
解得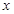 =0.1,
=0.1,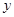 =0.4,故原混合物中CO2和H2O的物质的量比1:4。
=0.4,故原混合物中CO2和H2O的物质的量比1:4。
本题难度:一般
5、选择题 下列各物质的物质的量不能肯定是1 mol的是(? )
A.23 g金属钠所含的钠原子数
B.标准状况下,17 g氨气
C.22.4 L CO2气体
D.标准状况下10 L氧气和12.4 L氮气的混合物
参考答案:C
本题解析:使用22.4 L,必须是在标准状况下。23 g Na即为1 mol。
本题难度:简单