时间:2020-07-08 01:47:46
1、选择题 下列分离提纯方法错误的是
A.分离硝酸钾和氯化钠,常用结晶与重结晶
B.分离碘单质与氯化铵,常用升华法
C.分离叶绿体中色素可采用纸层析法
D.分离苯和酸性高锰酸钾溶液可用分液法
参考答案:B
本题解析:分析:A、根据硝酸钾和氯化钠的溶解度随温度的变化不同来分析;
B、根据碘单质加热升华,氯化铵加热也分解;
C、根据色素可采用纸层析法;
D、根据苯和酸性高锰酸钾溶液不相溶;
解答:A、氯化钠的溶解度受温度变化影响小,硝酸钾的溶解度受温度变化影响大,可用重结晶法分离,故A正确;
B、碘单质加热升华,氯化铵加热也分解,所以分离碘单质与氯化铵,不能用升华法,故B错误;
C、分离叶绿体中色素可采用纸层析法,故C正确;
D、苯和酸性高锰酸钾溶液不相溶,可用分液法分离,故D正确;
点评:本题主要考查了物质的分离,抓住物质性质的不同是解题的关键,难度中等.
本题难度:简单
2、选择题 在下列反应中,水是氧化剂的是
A.Cl2 + H2O
B.NO2 + H2O
C.Fe + H2O(g)
D.Na2O2 + H2O
参考答案:C
本题解析:水做氧化剂,由水中的氢得电子,应该放出氢气,在上面的选项中,只有C选项能放出氢气,所以正确答案应该选C。
本题难度:简单
3、填空题 FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是 (填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为 。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3+ 2KI = 2FeCl2+ I2+2KI,在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 色,再将混合液倒入 (填仪器名称)中,将两层液体分离。
参考答案:(1)2Fe3++Cu =2Fe2++Cu2+(2分)
(2)C(2分)丁达尔效应(1分)
(3)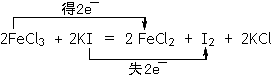 (3分)
(3分)
紫色(或紫红色)(2分) 分液漏斗(2分)
本题解析:(1)Cu把Fe3+还原为Fe2+,配平可得离子方程式:2Fe3++Cu =2Fe2++Cu2+。
(2)利用FeCl3的水解反应,当液体变为红褐色时即得到Fe(OH)3胶体,故C项正确;A项仍为FeCl3,B项和D项得到Fe(OH)3沉淀,均不符合题意;胶体具有丁达尔效应,故可用丁达尔效应检验胶体。
(3)Fe元素由+3价降为+2价,故2FeCl3转化为2FeCl2,得2e?,I元素由-1价升高为0价,2KI转化为I2,失2e?,即可用双线桥标出电子转移的方向和数目;I2的CCl4溶液为紫色或紫红色,I2的CCl4溶液和H2O分层,可用分液漏斗分离。
考点:本题考查离子方程式的书写、用双线桥标电子转移、胶体的制备和性质、溶液的颜色及物质的分离。
本题难度:一般
4、选择题 下列物质中,属于电解质的是
A.碳酸钙
B.石墨
C.酒精
D.氯化钠溶液
参考答案:A
本题解析:试题分析:A:CaCO3为离子化合物,在水溶液中或熔融状态下能导电是电解质,A错误;B:石墨是单质,B错误;C:酒精是共价化合物不导电,属非电解质,C正确;D:NaCl为离子化合物,在水溶液中或熔融状态下能导电是电解质,但氯化钠溶液是混合物,D错误;
选C.
考点:电解质与非电解质
本题难度:简单
5、选择题 糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是
A.植物油不能使溴的四氯化碳溶液褪色
B.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖
C.葡萄糖能发生水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
参考答案:B
本题解析:植物油中含有碳碳双键,能使溴水褪色,A不正确;葡萄糖是单糖,不能发生水解反应,C不正确;硫酸铜是重金属盐,使蛋白质变性,D不正确,答案选B。
本题难度:一般